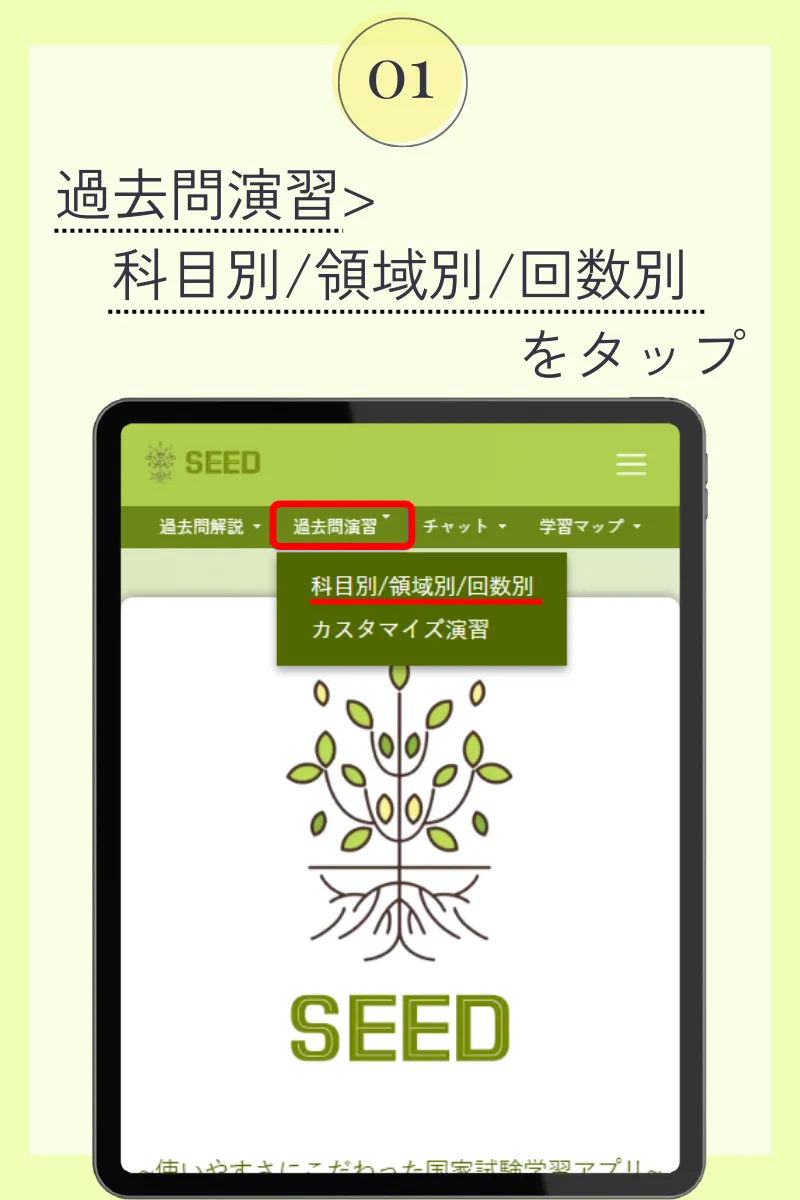
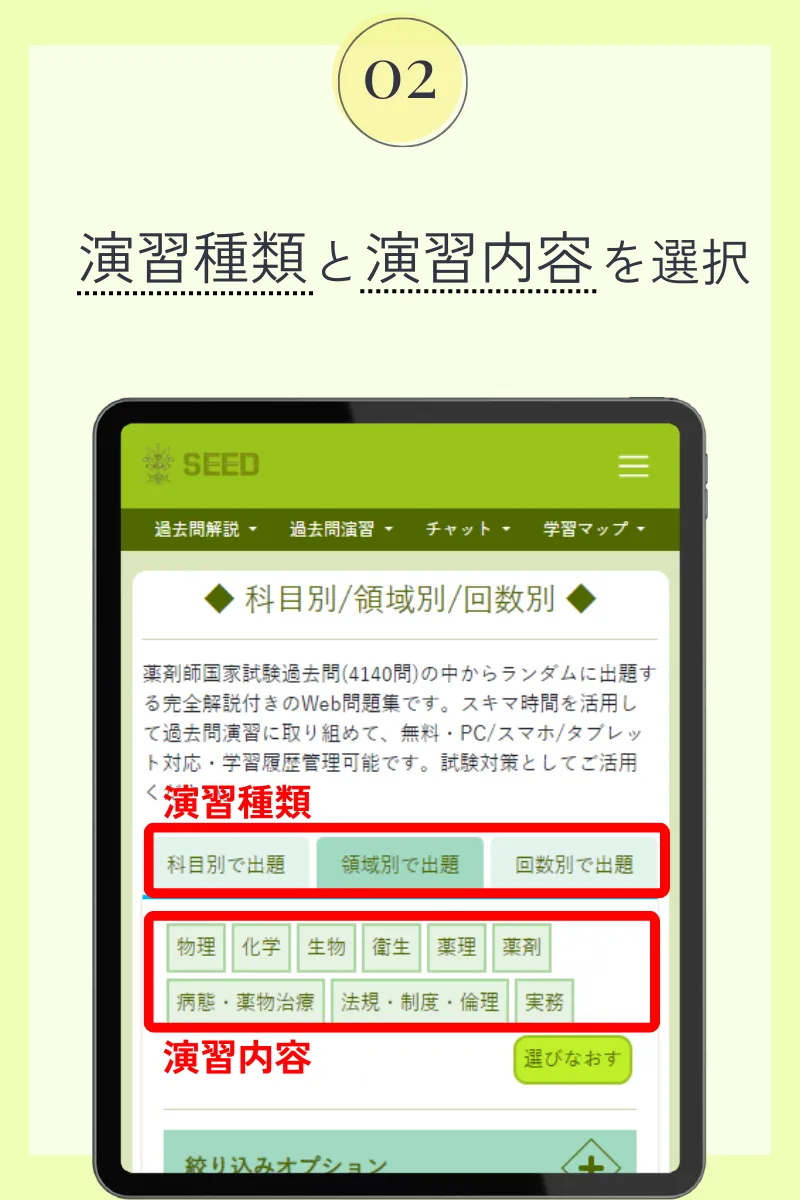
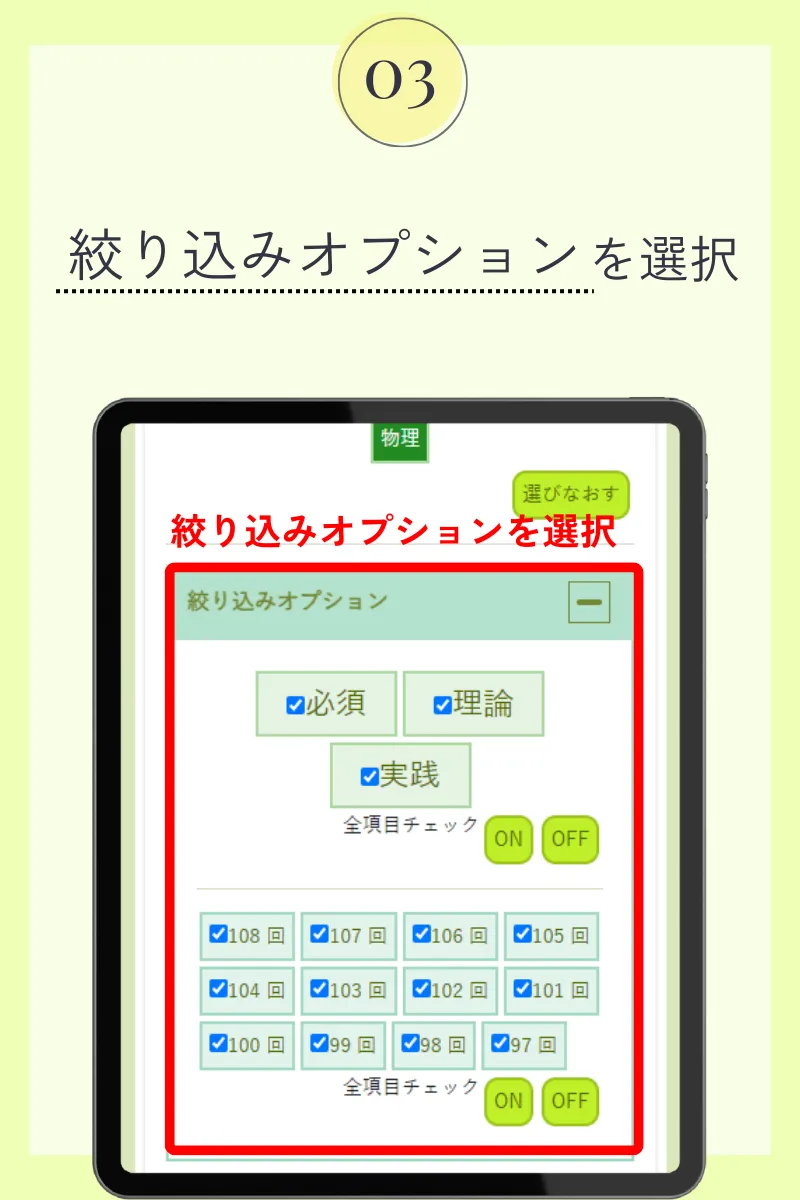
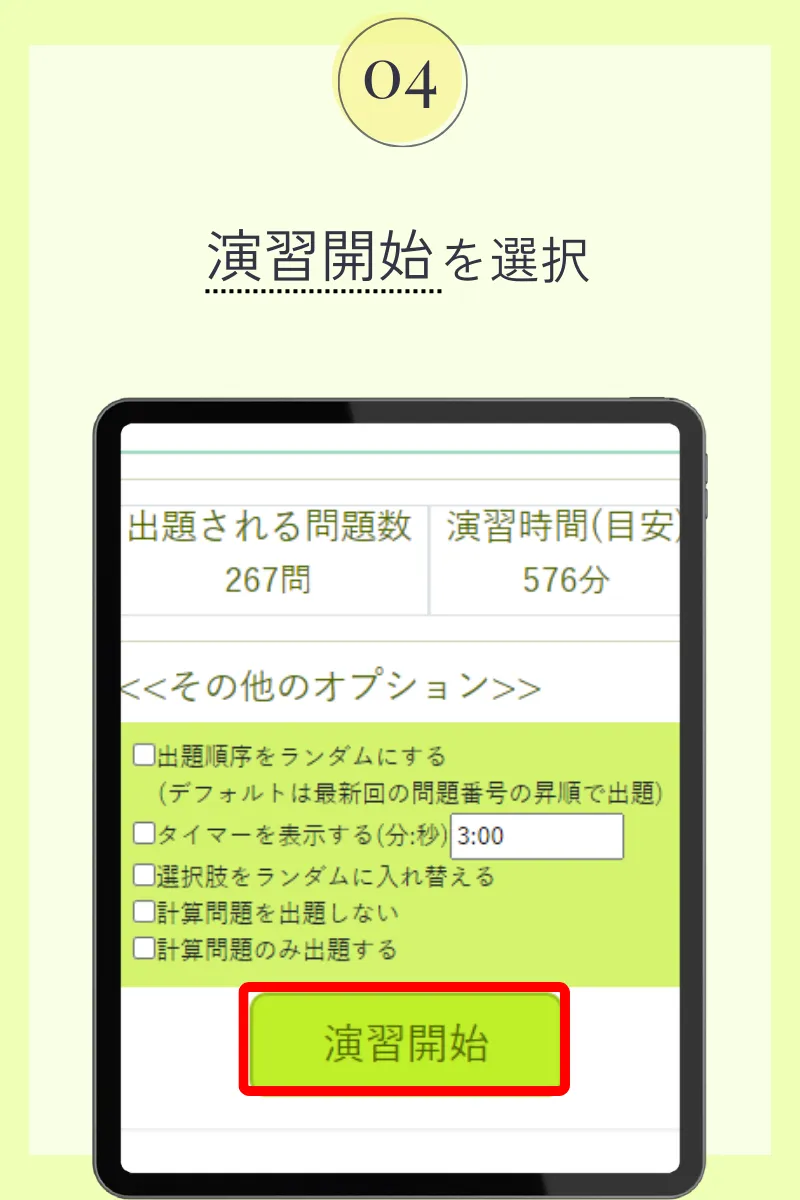
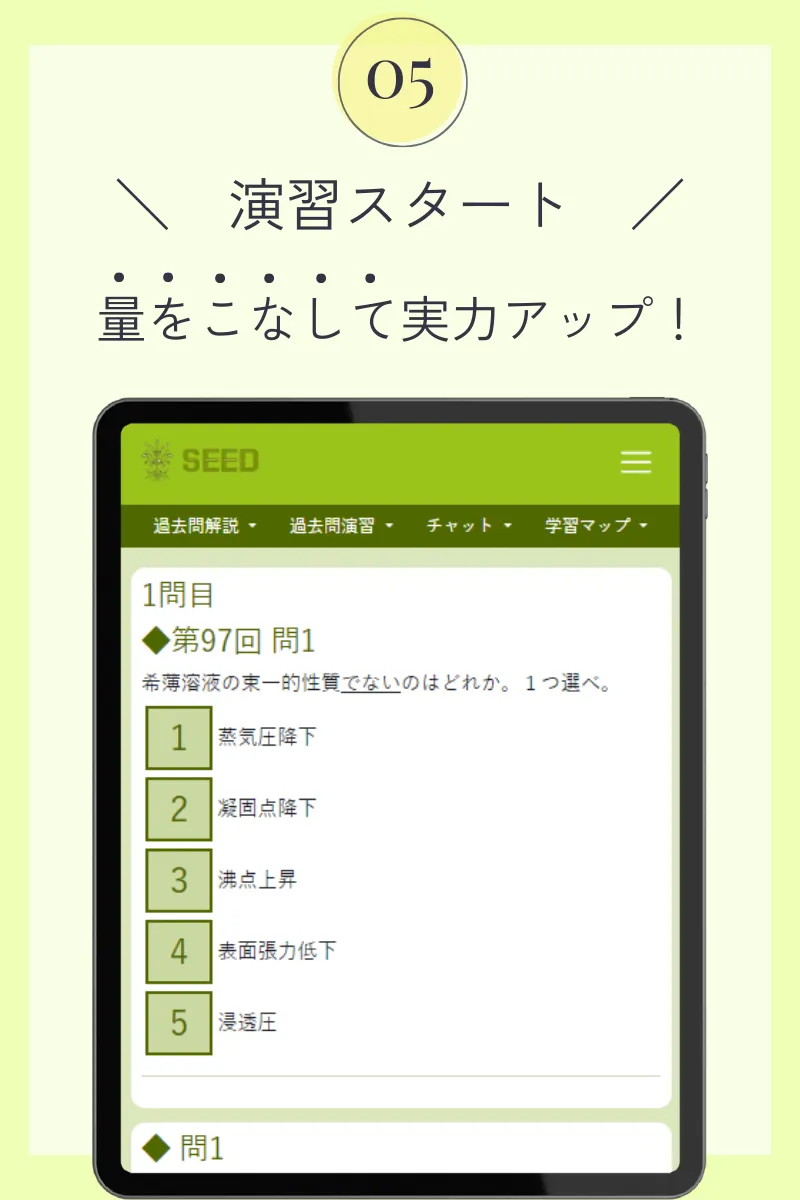
第102回薬剤師国家試験
◆ 問91
以下の化学反応式における熱力学的パラメータに関する記述のうち、誤っているのはどれか。1つ選べ。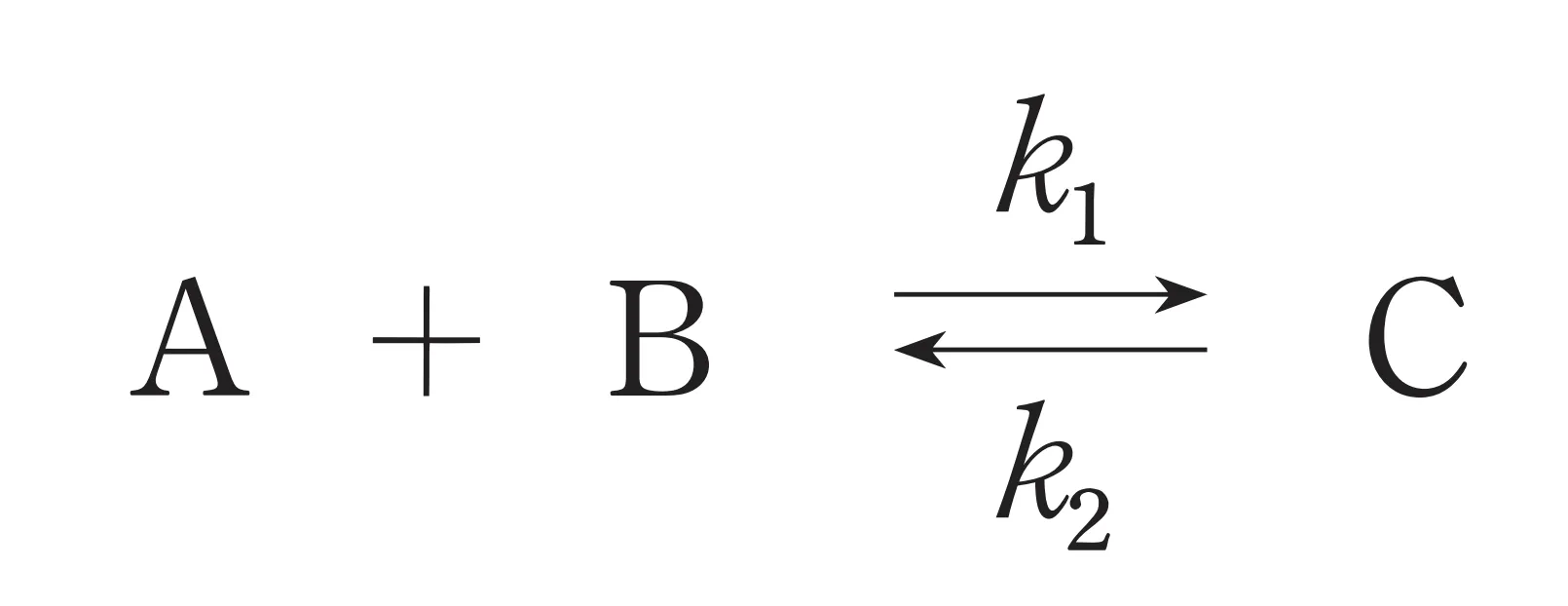
ただし、この反応における温度をT、平衡定数をK、反応速度定数をk1、k2とする。また、気体定数をRとする。
-
この反応の標準自由エネルギー差ΔG0は、ΔG0=-RTlnKで表すことができる。
-
いくつかの温度で測定した平衡定数から、反応の標準エンタルピー変化(ΔH0)を求めることができる。
-
ΔH0が正のときは吸熱反応となり、温度を上げると平衡が左にずれる。
-
反応速度定数k1は、exp(-Ea/RT)に比例する。なお、Eaは一般に活性化エネルギーといわれる。
-
活性化エネルギーが高いほど反応速度に対する温度の影響は大きい。
◆ 問91
◆領域・タグ
◆正解・解説
正解:3
1 正しい
可逆反応において、標準自由エネルギーの差ΔG0と平衡定数Kの関係は以下の式で表すことができる。
ΔG0=-RTlnK
2 正しい
いくつかの温度で測定した平衡定数から、ファントホッフプロットを得ることができ、その傾きより反応の標準エンタルピー変化(ΔH0)を求めることができる。
3 誤っている
温度が上昇すると、吸熱反応が促進するため、ΔH0が正(吸熱反応)のときは、温度を上げると平衡は右にずれる。
4 正しい
反応速度定数kと温度Tの関係は以下のアレニウス式より表される。
k=Aexp(-Ea/RT) A:頻度因子
よって、反応速度定数k1は、exp(-Ea/RT)に比例する。
5 正しい
活性化エネルギーが高いほど温度の変化により、反応速度の変化率が大きいため、活性化エネルギーが高いほど反応速度に対する温度の影響は大きい。