第103回薬剤師国家試験
◆問119-120
未知タンパク質Xを分離精製し、その特性を解析した。◆ 問119
◆ 問120
精製したタンパク質Xは単量体で酵素活性をもち、その活性発現には補因子を必要としないことが判明した。次に、タンパク質Xに対する1種類のモノクローナル抗体(anti−X)をマウスを用いて作製した。タンパク質Xの酵素活性、抗体作製及び細胞内局在の解析に関する記述のうち、正しいのはどれか。2つ選べ。ただし、精製の過程で酵素活性が失われることはなかった。-
試料イにおけるタンパク質Xの酵素活性は、試料アよりも高い。
-
タンパク質Xの比活性*は、試料アよりも試料ウにおいて高い。
*比活性:試料中のタンパク質の単位重量当たりの酵素活性 -
anti−Xを産生するハイブリドーマの作製には、マウス骨髄腫細胞が用いられる。
-
anti−Xは、タンパク質X中の複数の異なるエピトープ(抗原決定基)を認識する。
-
anti−Xと試料イを用いたウエスタンブロット法により、タンパク質Xの細胞内局在を同定することができる。
◆ 問119
◆領域・タグ
◆正解・解説
正解:2、3
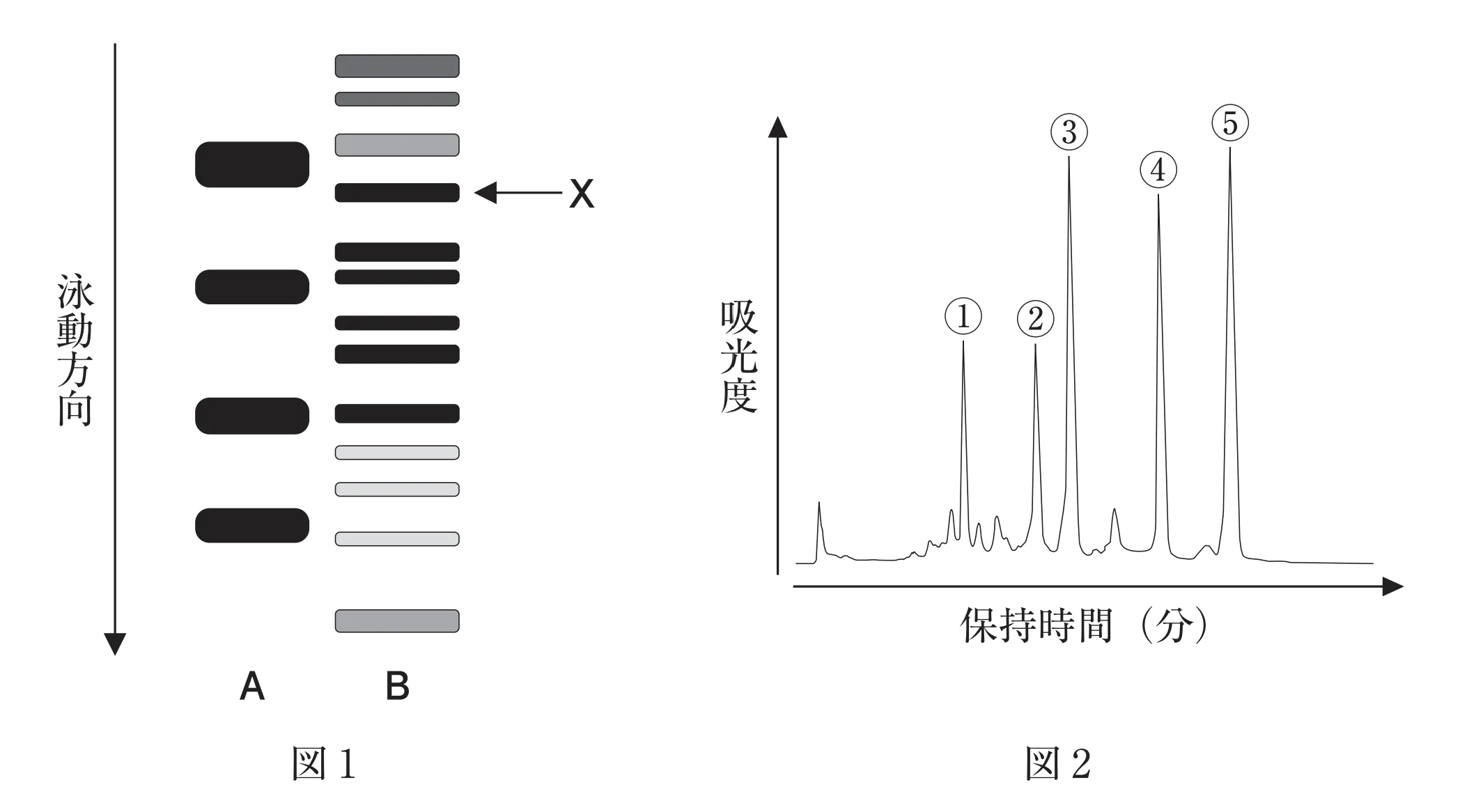
本問は、SDS−ポリアクリルアミドゲル電気泳動法(SDS−PAGE)とサイズ排除クロマトグラフィー(SEC)の2つの分析法が用いられており、図1ではSDS−PAGEの分析結果、図2ではSECの分析結果を表している。
SDS−PAGEは、ポリアクリルアミドゲルを用いてタンパク質の分子量(分子サイズ)の違いで分離する方法である。分離の前処理として、還元剤の2−メルカプトエタノールと陰イオン性界面活性剤のSDSを添加する。2−メルカプトエタノールによりタンパク質を還元的に前処理することで、ジスルフィド結合を切断し直鎖状ペプチドとする。SDSにより、直鎖状ペプチドの疎水部分にSDS分子が疎水結合し、直鎖状ペプチドは負に荷電する。上記の前処理後、ポリアクリルアミドゲル中での移動度により分子量の違いで分離をすることができる。このとき、試料は陰極から陽極に泳動し、分子量の小さい成分ほど移動度は大きい。
SECは、固定相に分子ふるい効果をもつ多孔性ゲルを用いて、アミノ酸、タンパク質などを分子量の違いにより分離する方法である。多孔性ゲルを用いると小さな分子はゲルの内部に侵入するが、大きな分子はゲルの外側を通り抜ける。そのため、ゲルの内部に侵入しない分子量の大きな成分は、分子量の小さい成分に比べてカラムから早く溶出する。
1 誤
SDS−PAGEでは、タンパク質をSDSと2−メルカプトエタノールで還元的に前処理することで分子量に基づいた分離が可能になる。
2 正
上記参照
3 正
SDS−PAGEでは分子量の小さい成分ほど移動度は大きくなる。そのため、図1のレーンAの4種の分子量マーカータンパク質は、55 kDa、40 kDa、35 kDa、25 kDaの順に移動度は大きくなる。下図で示すとおり、タンパク質Xは、55 kDaと40 kDaの間に分離されていることから分子量は、40 kDaから55 kDaの間である。
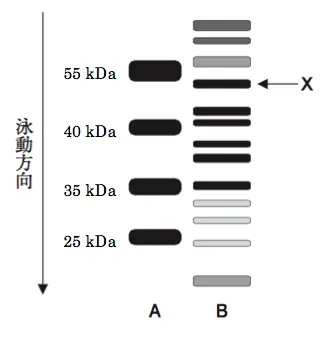
4 誤
SECは、固定相に多孔性ゲルを用いる。なお、プロテインA固定化シリカゲルを用いるのはアフィニティークロマトグラフィーである。
5 誤
SECは、分子量の大きな成分ほどカラムから早く溶出する(保持時間が小さい)。そのため、タンパク質Xの単量体と25 kDa、35 kDa、40 kDa、55 kDaの4種の分子量マーカータンパク質を混合して分離したとき、55 kDa(①)、タンパク質Xの単量体(②)、40 kDa(③)、35 kDa(④)、25 kDa(⑤)の順にカラムから溶出する。よって、タンパク質Xの単量体のピークは②である。
問120 解答 2、3
1 誤
試料イは、試料アが還元剤の2−メルカプトエタノールや陰イオン性界面活性剤のSDSを添加して前処理されることで、ジスルフィド結合の切断などによりタンパク質が変性しているため、酵素活性が低下している。そのため、試料イにおけるタンパク質Xの酵素活性は、試料アよりも低い。
2 正
試料アはタンパク質Xを含む細胞抽出液であり、タンパク質X以外のタンパク質が混入している。一方、試料ウは、SECによる分離が行われており、タンパク質Xのみを精製した試料となっている。そのため、比活性(試料中のタンパク質の単位重量当たりの酵素活性)は試料アよりも純度が高い試料ウにおいて高い。
3 正
ハイブリドーマとは、複数の細胞が融合してできた融合細胞のことである。一般的にモノクローナル抗体を産生するハイブリドーマは、B細胞と骨髄腫細胞を融合させて作製する。B細胞は抗体産生能をもつが寿命が短いため、目的とするモノクローナル抗体を産生することができても、その抗体を産生させ続けることができない。そこで、抗体産生能をもつB細胞と無限増殖能を持った骨髄腫細胞を融合させることで、目的とするモノクローナル抗体の継続的な産生が可能となったハイブリドーマを作製することができる。本設問では、「タンパク質Xに対する1種類のモノクローナル抗体(anti−X)をマウスを用いて作製した。」と記述があるため、anti−Xを産生するハイブリドーマの作製には、マウス骨髄腫細胞が用いられる。
4 誤
anti−Xはモノクローナル抗体のため、タンパク質X中の一種類のエピトープ(抗原決定基)だけを認識する。なお、複数の異なるエピトープ(抗原決定基)を認識する抗体集団をポリクローナル抗体という。
5 誤
ウエスタンブロット法によるタンパク質の細胞内局在を同定するには、細胞分画する必要がある。細胞分画をしていない場合、試料中での目的のタンパク質の有無はわかるが、細胞内のどこに局在しているか同定することはできない。また、試料イに含まれているタンパク質Xは、2−メルカプトエタノールとSDSの添加により変性しているため、エピトープとなる部位の構造が変化している可能性がある。そのため、anti−Xによるエピトープの認識をすることができず、細胞内局在の同定はできないと考えられる。
◆ 問120
◆領域・タグ
◆正解・解説
正解:2、3
1 誤
試料イに含まれるタンパク質Xは、2−メルカプトエタノールやSDSにより変性しているためタンパク質としての活性が低下している。よって、試料イにおけるタンパク質Xの酵素活性は、試料アよりも低い。
2 正
試料ウには精製したタンパク質Xが含まれているため、タンパク質Xの比活性は、試料ア(タンパク質Xを含む細胞抽出液)よりも試料ウにおいて高い。
3 正
anti−Xのようなモノクローナル抗体を産生するハイブリドーマは、一般に抗体産生能を有するB細胞と無限増殖能を有する骨髄細胞を融合して作成される。
4 誤
anti−Xは、モノクローナル抗体であることから、タンパク質X中の特定のエピトープ(抗原決定基)を認識する。
5 誤
anti−Xと試料イを用いたウエスタンブロット法により、タンパク質Xの同定を行うことは可能であるが、細胞内局在(細胞のどこに存在するか)を同定することはできない。細胞内局在を同定するためには、遠心分離等により細胞分離する必要がある。