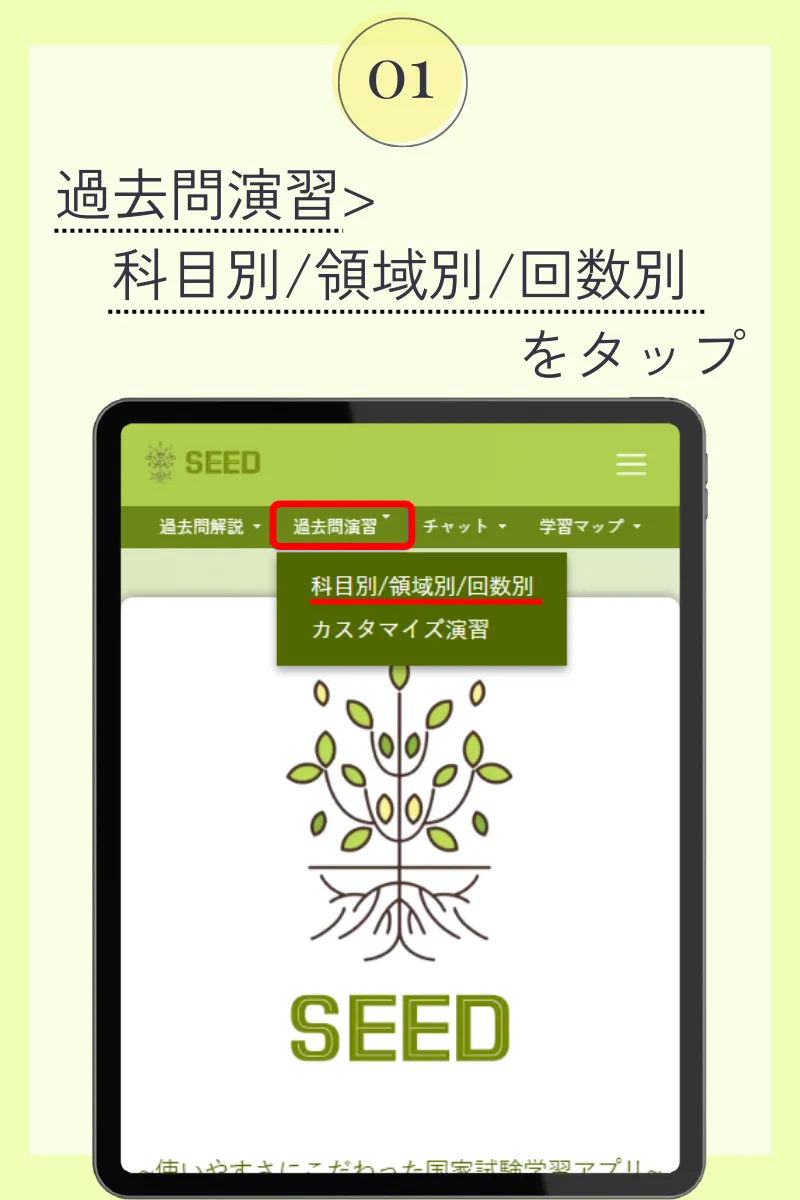
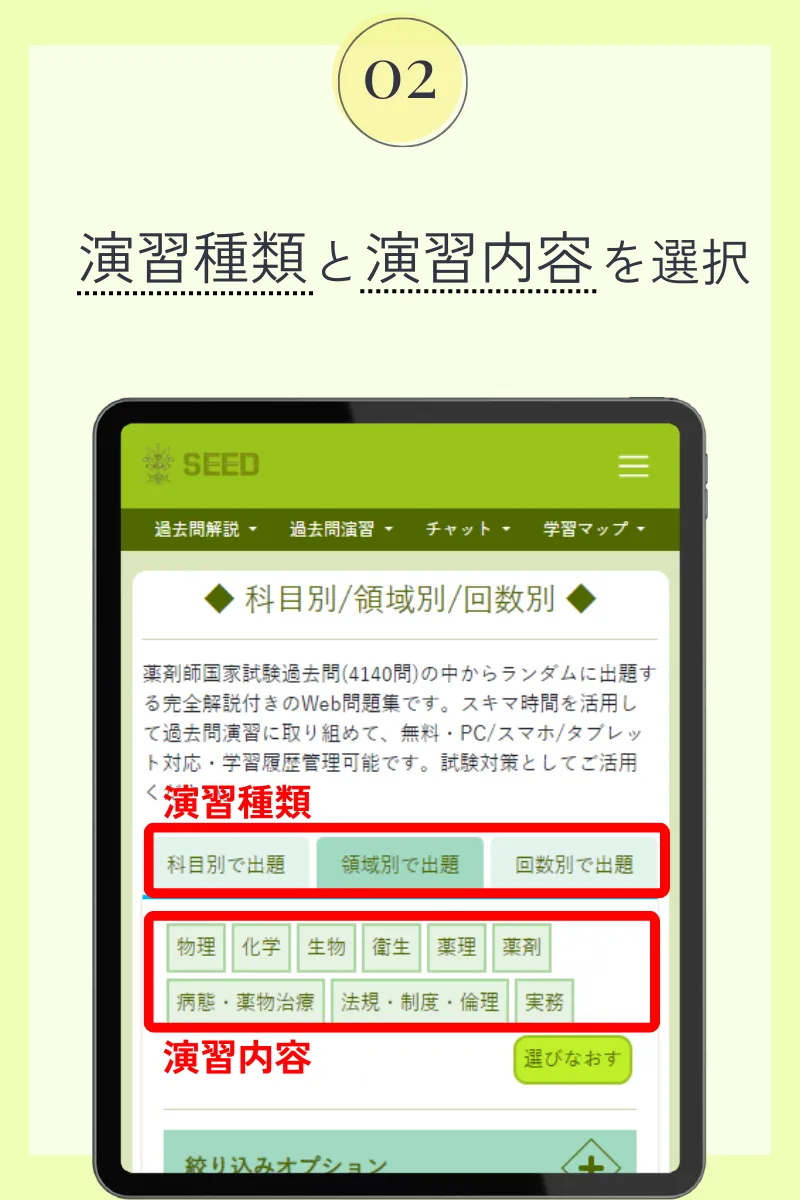
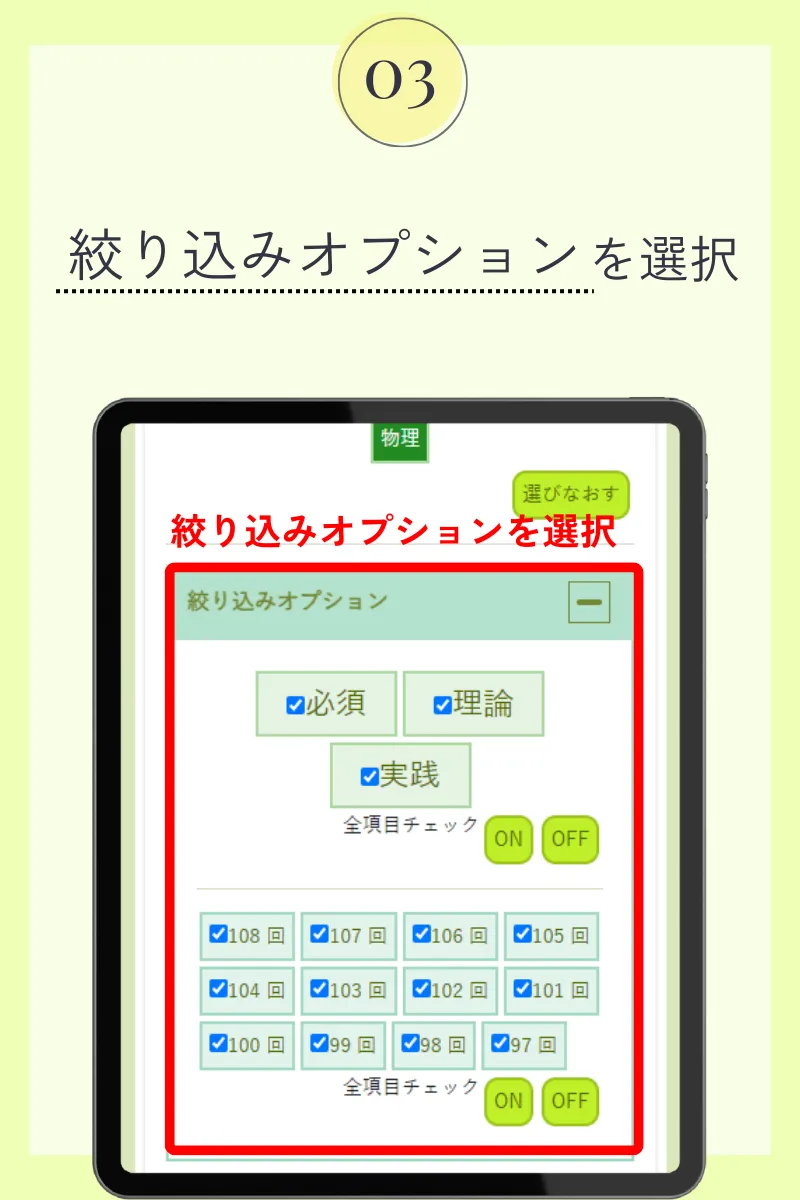
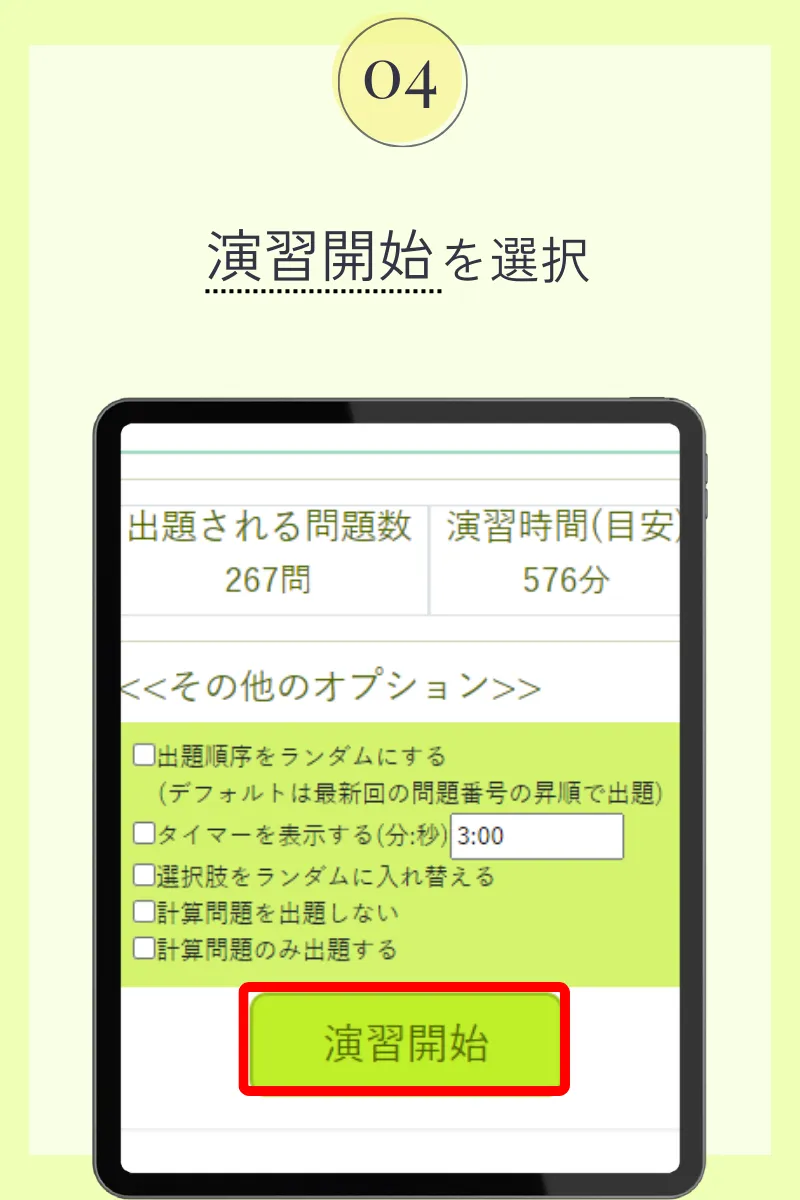
第103回薬剤師国家試験
◆ 問190
医薬品リスク管理計画(Risk Management Plan:RMP)に関する記述のうち、正しいのはどれか。2つ選べ。-
RMPは、治験の第三相試験を開始するまでに策定しなければならない。
-
安全性検討事項は、重要な特定されたリスク、重要な潜在的リスク、重要な不足情報に分類される。
-
市販直後調査は、医薬品安全性監視計画に含まれる。
-
添付文書の作成や改訂は、リスク最小化計画には含まれない。
-
バイオ後続品については、RMPを策定しなくてもよい。
◆ 問190
◆領域・タグ
◆正解・解説
正解:2、3
医薬品リスク管理計画(Risk Management Plan:RMP)は、医薬品の安全性を確保するために開発の段階から承認審査を経て製造販売に至るまでを医薬品ごとにひとつの文書にまとめ、医療関係者、行政、製薬企業など医薬品の適正使用に関わる全ての関係者で共有することで、市販後安全対策の一層の充実強化を測ることを目的としたものである。
1 誤
医薬品リスク管理計画(Risk Management Plan:RMP)は、医薬品の安全性を確保するために開発の段階から承認審査を経て製造販売に至るまでを医薬品ごとにひとつの文書にまとめたものであり、治験の第三相試験を開始するまでに策定しなければならないという規定はない。
2 正
3 正
医薬品安全性監視活動(情報取集)には、副作用症例の収集、市販直後調査による情報収集、使用成績調査、市販後臨床試験などが含まれる。
4 誤
添付文書の作成、改定はリスク最小化計画に含まれる。
5 誤
RMPの適用範囲は、医療用医薬品であり、後発医薬品やバイオ後続医薬品についてもRMPが策定される。