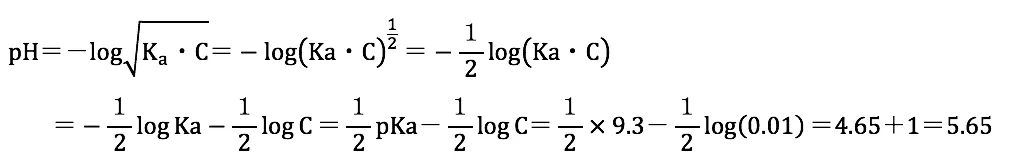第103回薬剤師国家試験
◆ 問96
0.01 mol/L塩化アンモニウム水溶液のpHに最も近い値はどれか。1つ選べ。ただし、アンモニアのpKbを4.70、水のイオン積Kwを1.00×10-14(mol/L)2とする。-
3.65
-
5.65
-
8.35
-
9.30
-
10.35
◆ 問96
◆領域・タグ
◆正解・解説
正解:2
塩化アンモニウム(NH4Cl)は水溶液中で下記のように解離する。
NH4Cl → NH4+ + Cl-
塩化アンモニウムから発生したアンモニウムイオン(NH4+)は水中で下記のような反応が起こす。
NH4+ ⇆ NH3 + H+
アンモニアのpKbは4.70、水のイオン積Kwは1.00×10-14(pKw=14)であることからアンモニウムイオンのpKaは下記のように求めることができる。
pKa+pKb=pKw
pKa=14-pKb=14-4.70=9.3
アンモニウムイオンのpKa=9.3である(弱酸である)ことから、アンモニウムイオンから発生する[H+]は以下の式より求めることができる。
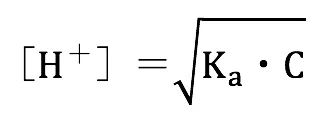
また、pHは下記の式で求めることができる。
pH=-log[H+]
上記のことから、pHは下記ように求めることができる。