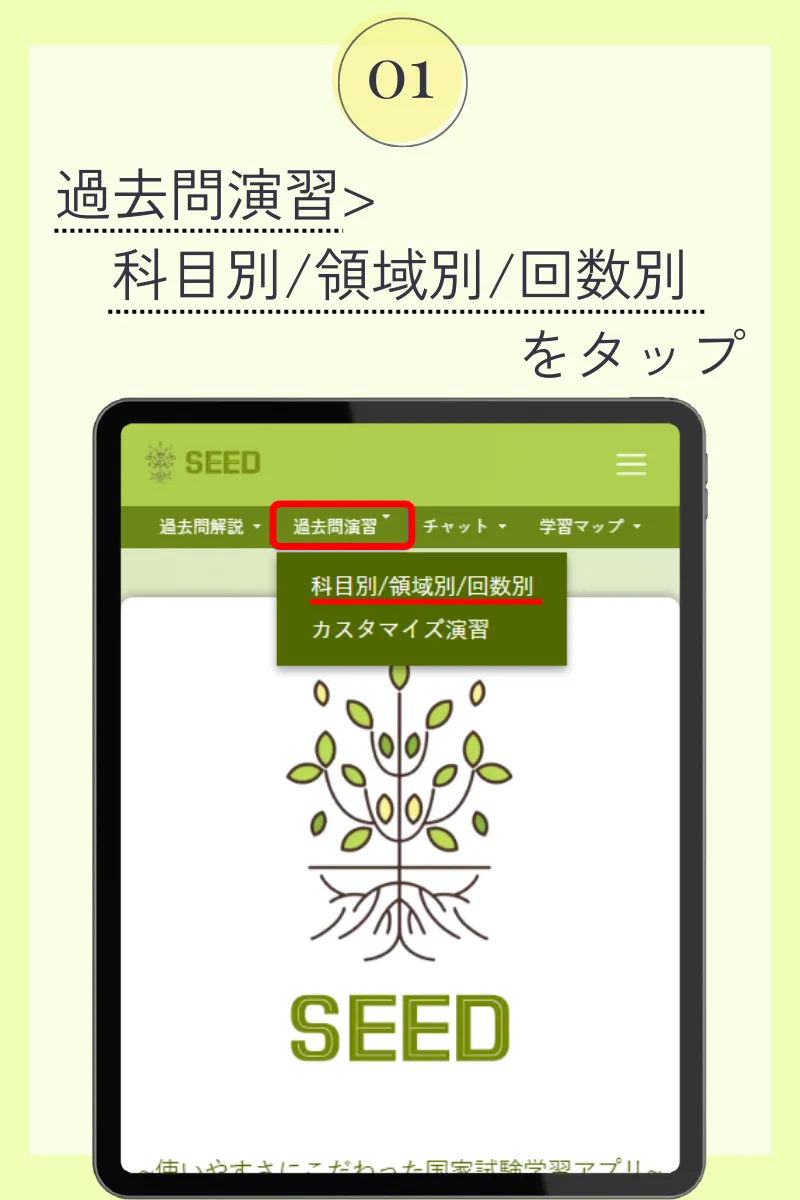
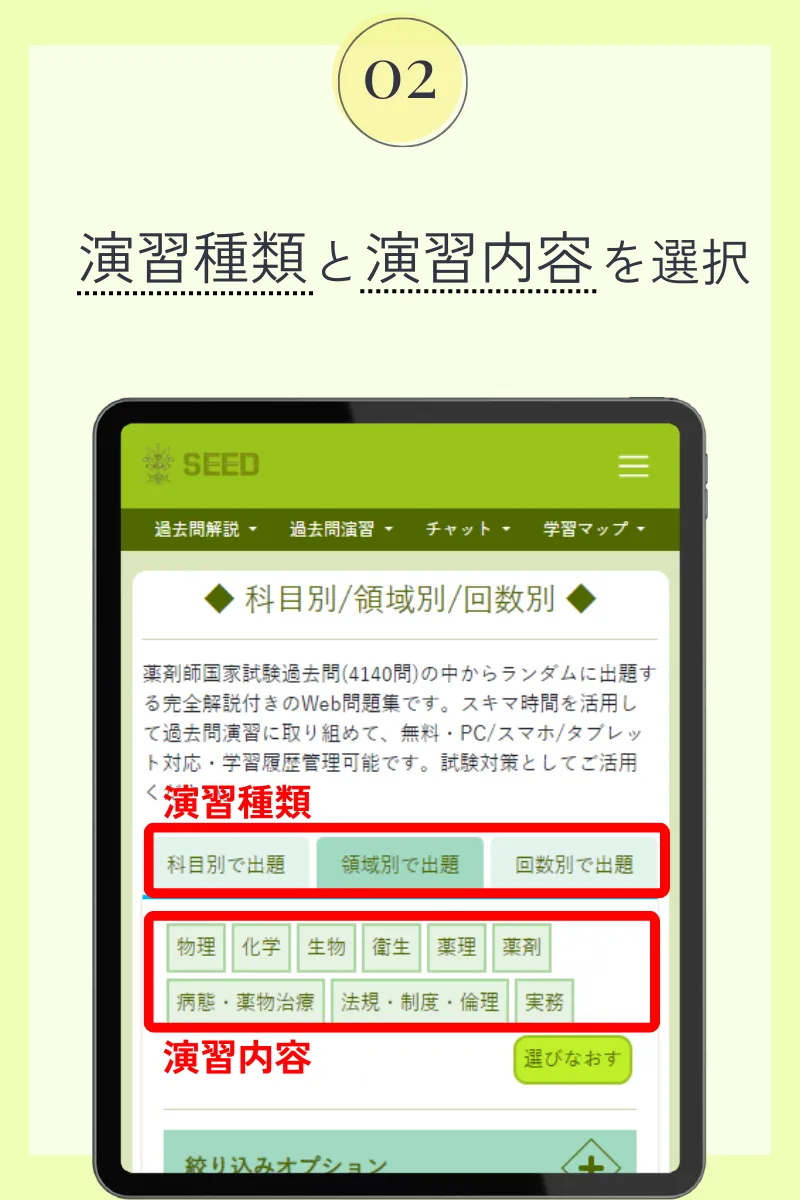
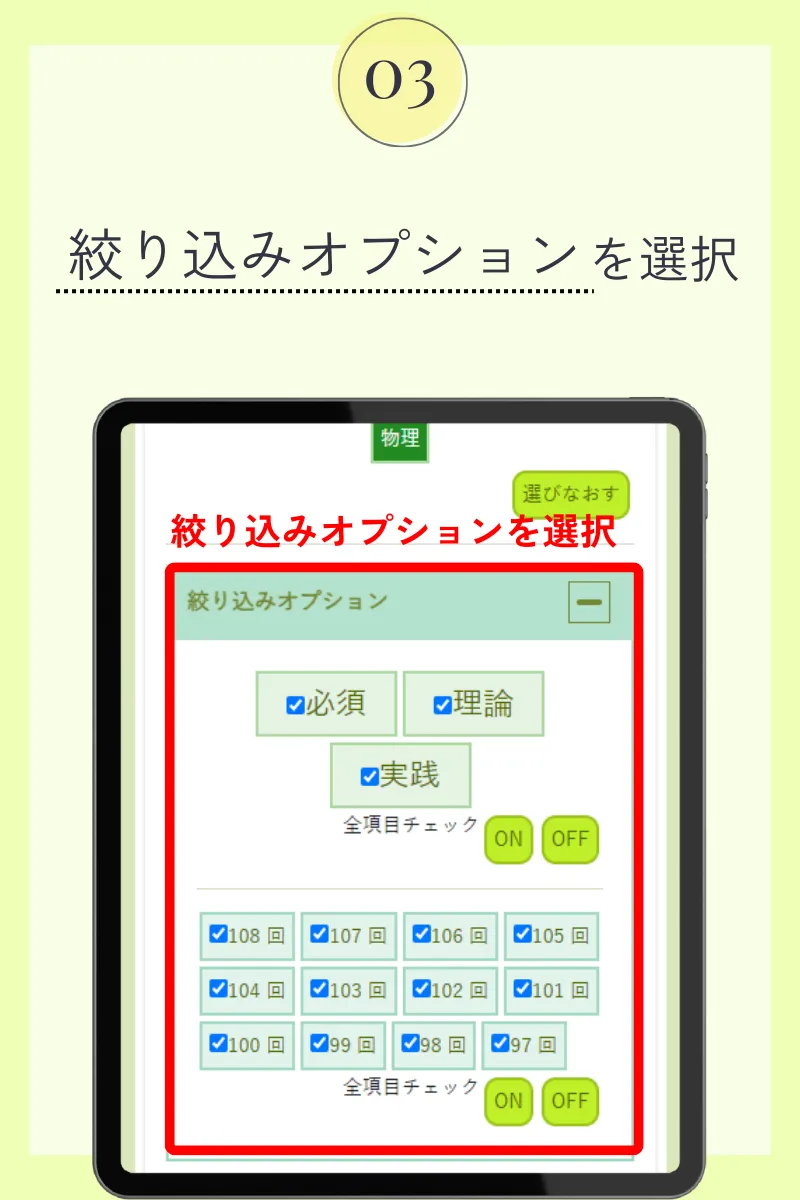
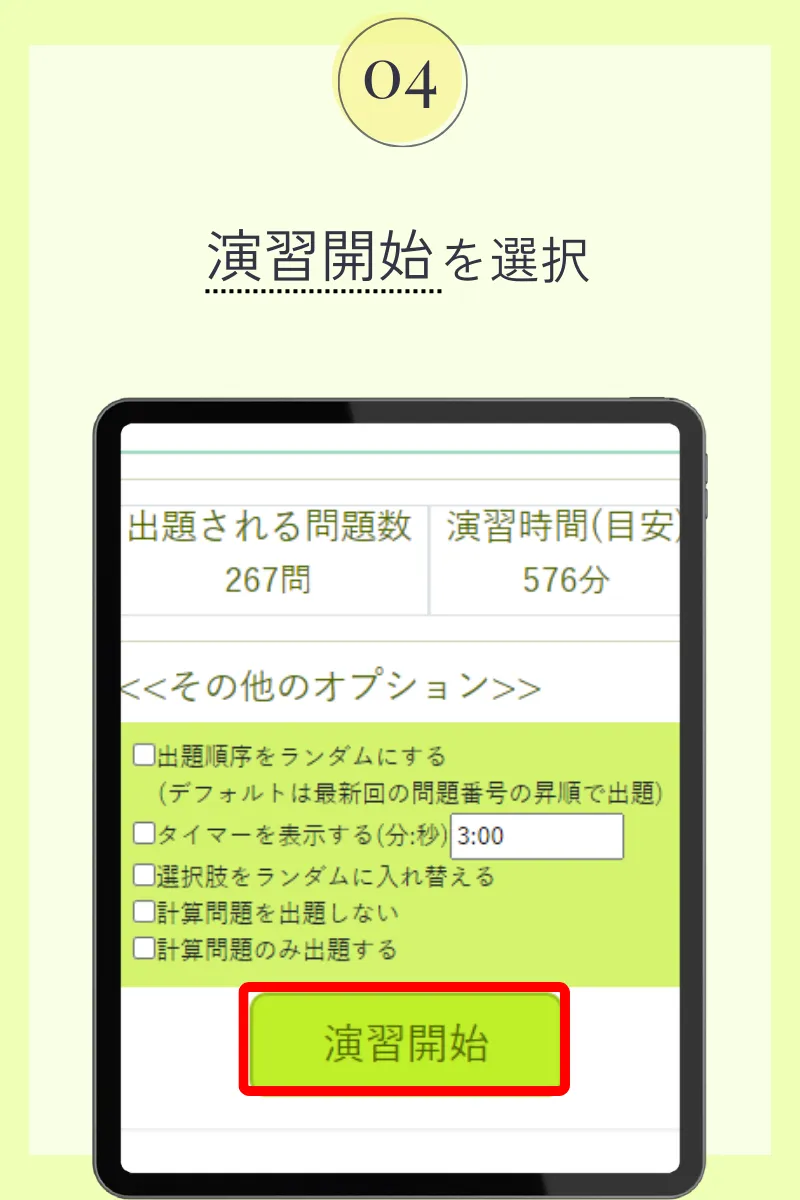
第104回薬剤師国家試験
◆ 問2
濃度未知の水酸化ナトリウム水溶液を、0.01 mol/L塩酸標準液(ファクターf=1.020)を用いて滴定したところ、滴定終点までに6.10 mLを要した。この水酸化ナトリウム水溶液中の水酸化ナトリウムの量(µmol)として適切なのはどれか。1つ選べ。-
59.80
-
59.8
-
61.00
-
62.2
-
62.22
◆ 問2
◆領域・タグ
◆正解・解説
正解:4
滴定により目的成分の量を求める際には、下記の式が用いられる。
目的成分の量=標準液の濃度×標準液の消費量×ファクターf
上記の式より、本滴定により得られる水酸化ナトリウム水溶液中の水酸化ナトリウムの量は、0.01 mol/L×6.10 mL×1.020=62.22 µmolとなる。
「有効数字を考慮した測定値の加減計算では、それぞれの数値の中で小数点以下の桁数が最も少ない数値に支配される。一方、乗除計算では、それぞれの数値の中で有効桁数が最も少ない数値に支配される。」
目的成分の量は、乗除計算により求めることができ、また、標準液の消費量の有効桁数が3桁であることから、水酸化ナトリウム水溶液中の水酸化ナトリウムの量は「62.2(µmol)」となる。