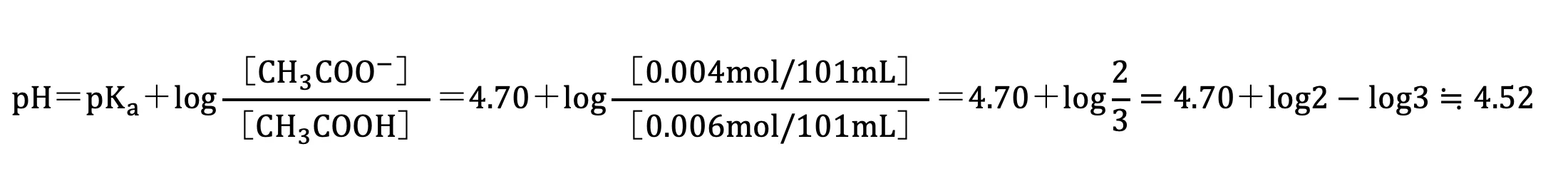第104回薬剤師国家試験
◆ 問91
0.200 mol/L酢酸50.0 mLに0.100 mol/L水酸化ナトリウム水溶液50.0 mLを加えた。その後、この混合溶液に対して1.00 mol/L塩酸を1.00 mL加えた溶液のpHに最も近い値はどれか。1つ選べ。ただし、酢酸のpKa=4.70、log2=0.301、log3=0.477とする。-
2.01
-
3.41
-
4.52
-
4.70
-
4.93
◆ 問91
◆領域・タグ
◆正解・解説
正解:3
酢酸に水酸化ナトリウム水溶液を加えると、下記に示す反応が進行する。
CH3COOH + NaOH → CH3COONa + H2O
0.200 mol/L酢酸50.0 mLには酢酸が0.01 mol含まれており、0.100 mol/L水酸化ナトリウム水溶液50.0 mLには、水酸化ナトリウムが0.005 mol含まれていることから、0.200 mol/L酢酸50.0 mLに0.100 mol/L水酸化ナトリウム水溶液50.0 mLを加えると、100mL中にCH3COOH 0.005 molとCH3COONa 0.005 molを含む混合液Ⅰができる。
この混合液Ⅰに1.00 mol/L塩酸を1.00 mLを加えると、下記に示す反応が進行する。
CH3COONa + HCl → CH3COOH + NaCl
1.00 mol/L塩酸を1.00 mLには、塩酸が0.001mol含まれていることから、混合液Ⅰに1.00 mol/L塩酸を1.00 mLを加えると、101mL中にCH3COOH 0.006 molとCH3COONa 0.004 molを含む混合液Ⅱができる。
混合液Ⅱには、酢酸と酢酸ナトリウムが含まれていることから、この混合液Ⅱは緩衝作用を示す(緩衝液である)。上記より、混合液ⅡのpHを下記のように求めることができる。