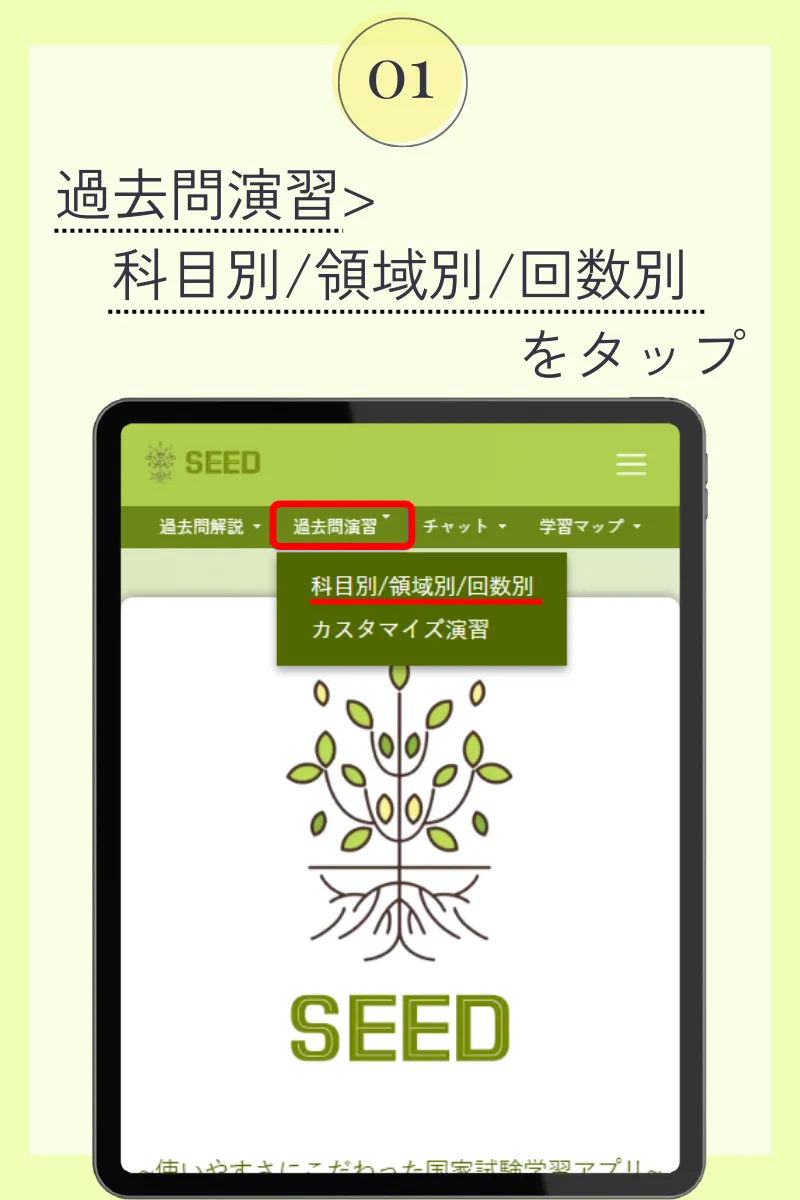
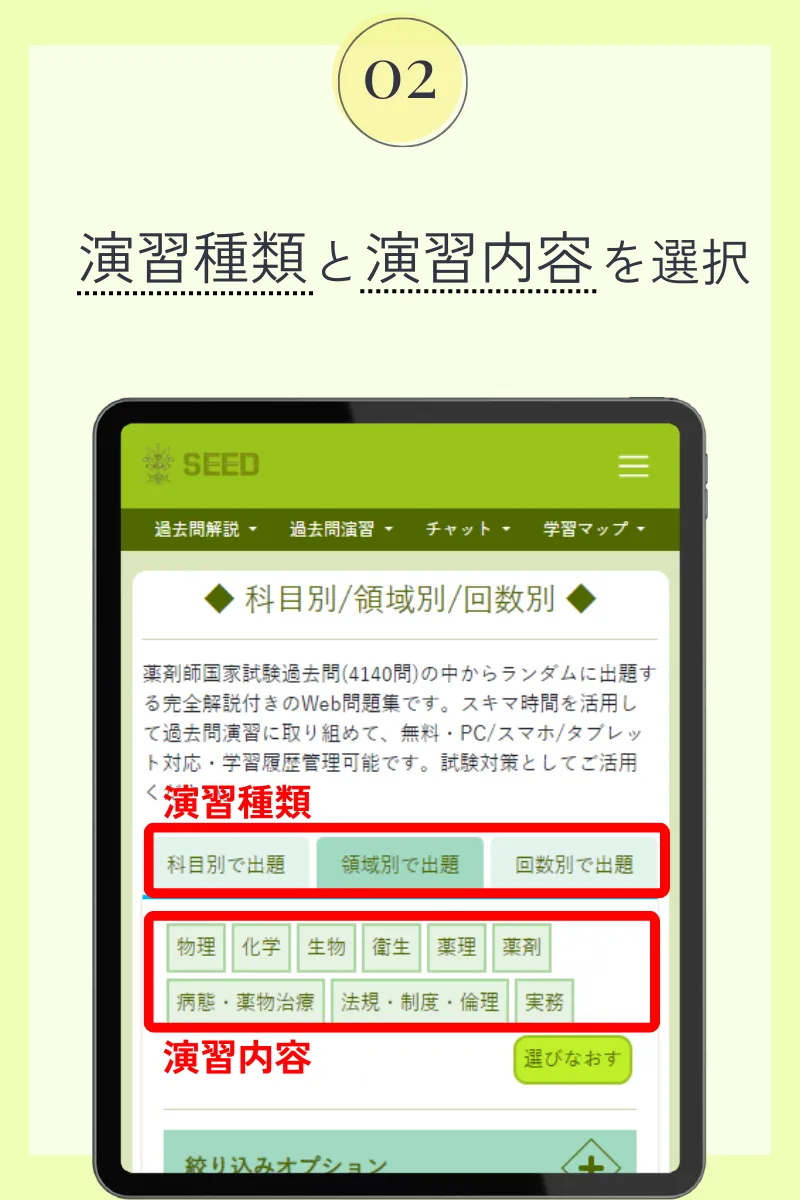
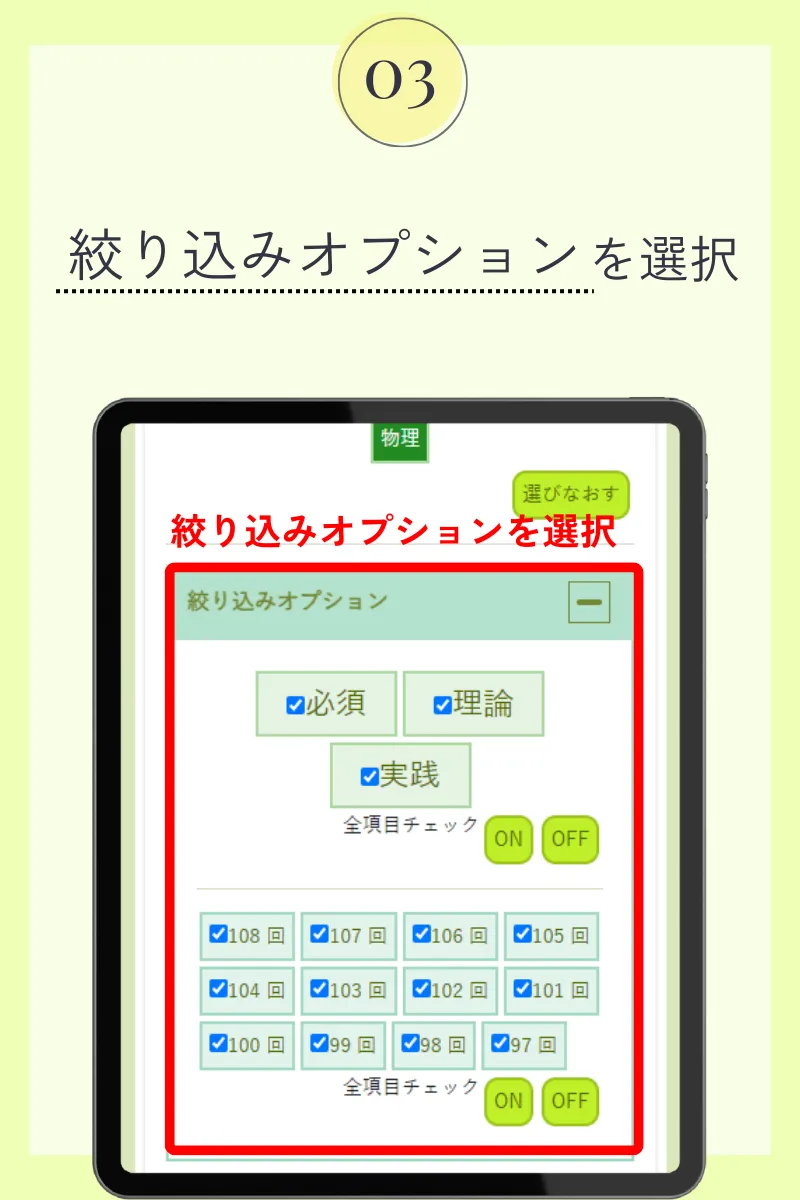
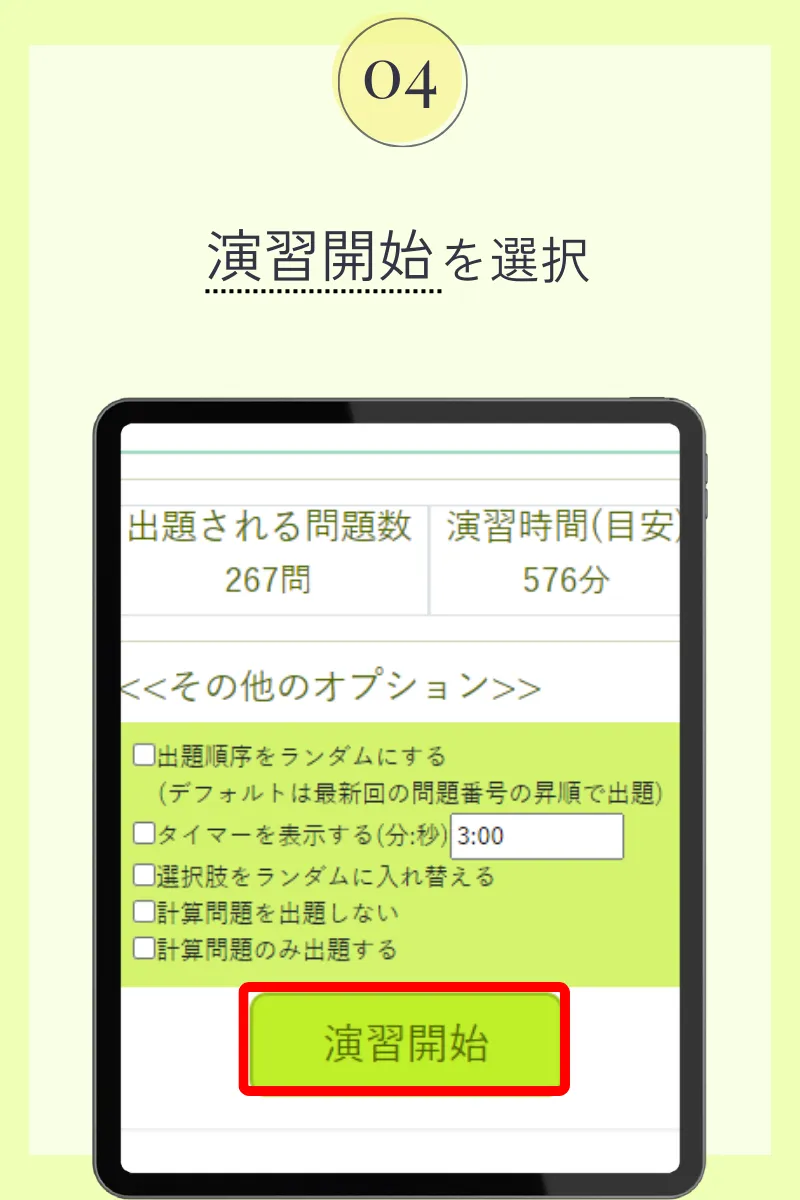
第104回薬剤師国家試験
◆ 問93
日本薬局方キシリトール(C5H12O5:152.15)の定量法に関する記述のうち、正しいのはどれか。2つ選べ。「本品を乾燥し、その約0.2gを精密に量り、水に溶かし、正確に100mLとする。この液10mLを正確に量り、ヨウ素瓶に入れ、過ヨウ素酸カリウム試液50mLを正確に加え、水浴中で15分間加熱する。冷後、ヨウ化カリウム2.5gを加え、直ちに密栓してよく振り混ぜ、暗所に5分間放置した後、遊離したヨウ素を0.1mol/L「 A 」で滴定する(指示薬:「 B 」3mL)」
C5H12O5 + 4IO4- → 2「 C 」+3「 D 」+4IO3-+H2O
-
キシリトールと過ヨウ素酸カリウムの反応で酸化数が変化している原子は、それぞれの分子中の酸素とヨウ素である。
-
「 A 」はチオシアン酸アンモニウム液である。
-
「 B 」はデンプン試液である。
-
「 C 」はCH3CHO(アセトアルデヒド)である。
-
「 D 」はHCOOH(ギ酸)である。
◆ 問93
◆領域・タグ
◆正解・解説
正解:3、5
<キシリトールの定量における反応>
過ヨウ素酸カリウム(KIO4)は、1,2−ジオールを酸化的に開裂する酸化剤であり、キシリトールには、1,2−ジオール構造を構成するC−C結合が4つあるため、キシリトールと過ヨウ素酸カリウムは1:4のモル比で反応する。
C5H12O5 + 4IO4- → 2HCHO +3HCO2H + 4IO3-+ H2O
上記の反応より、「 C 」には、HCHO(ホルムアルデヒド)、「 D 」には、HCO2H(ギ酸)が当てはまる。また、上記の反応が起こる際、過ヨウ素酸カリウム中のヨウ素の酸化数が低下するとともに、キシトールに含まれる炭素の酸化数が増加する。
過ヨウ素酸イオン(IO4-)、ヨウ素酸イオン(IO3-)はともに酸化力を有しており、ヨウ素イオンと下記のような反応を示す。
IO4-+7I-+ 8H+→ 4I2 + 4H2O
IO3-+6I-+ 6H+→ 3I2 + 3H2O
上記のことから、キシリトール1molに対してヨウ素が4mol消費されるため、空試験と本試験のヨウ素のモル数の差より、キシリトールのモル数が求まる。
本定量法では、過ヨウ素酸イオン(IO4-)、ヨウ素酸イオン(IO3-)から遊離したヨウ素をチオ硫酸ナトリウムで滴定することにより、キシリトールの定量を行う。その際、滴定の終点を検出するために指示薬としてデンプンを用いる。このことから、「 A 」にはチオ硫酸ナトリウム、「 B 」にはデンプンが当てはまる。