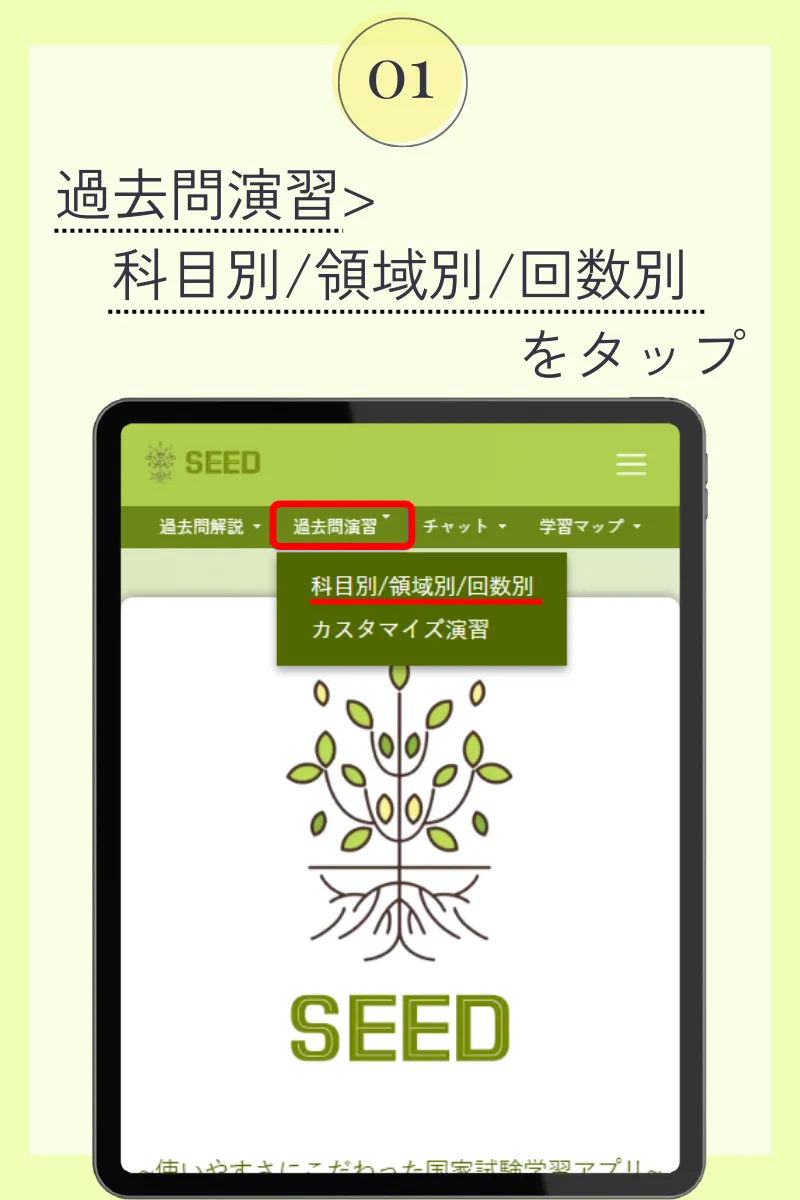
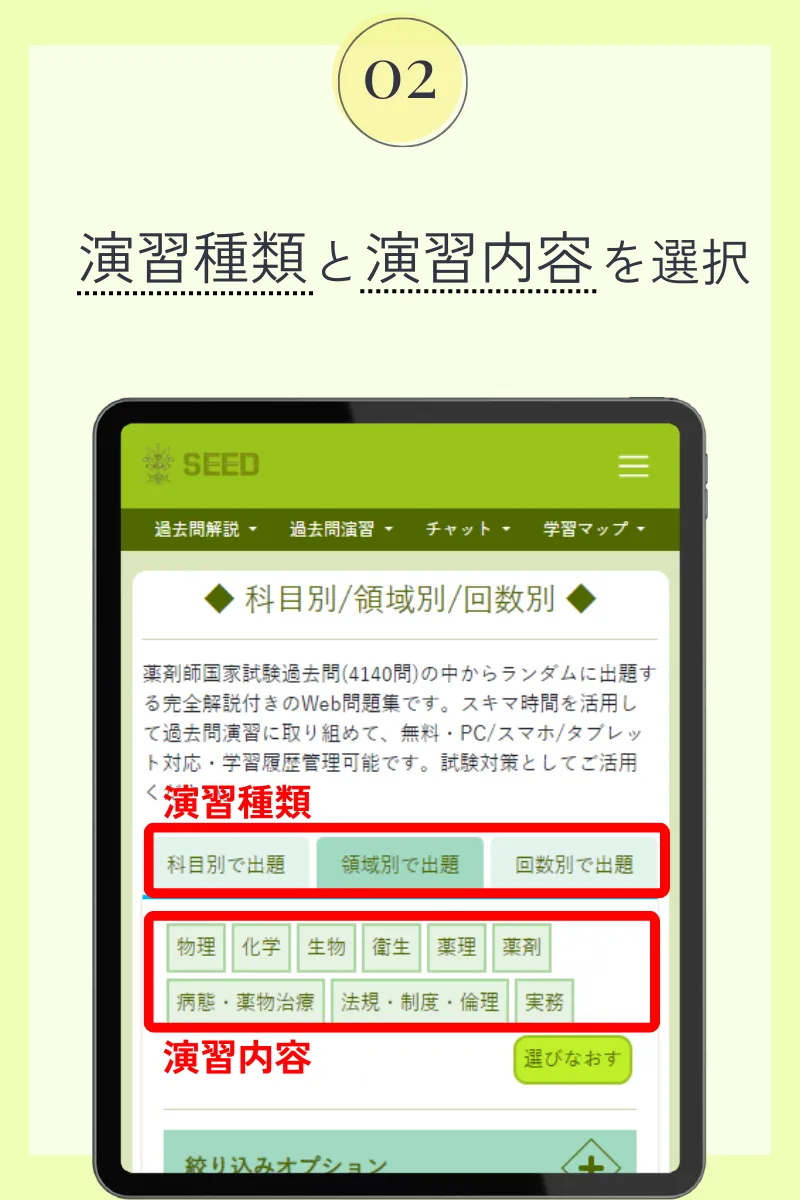
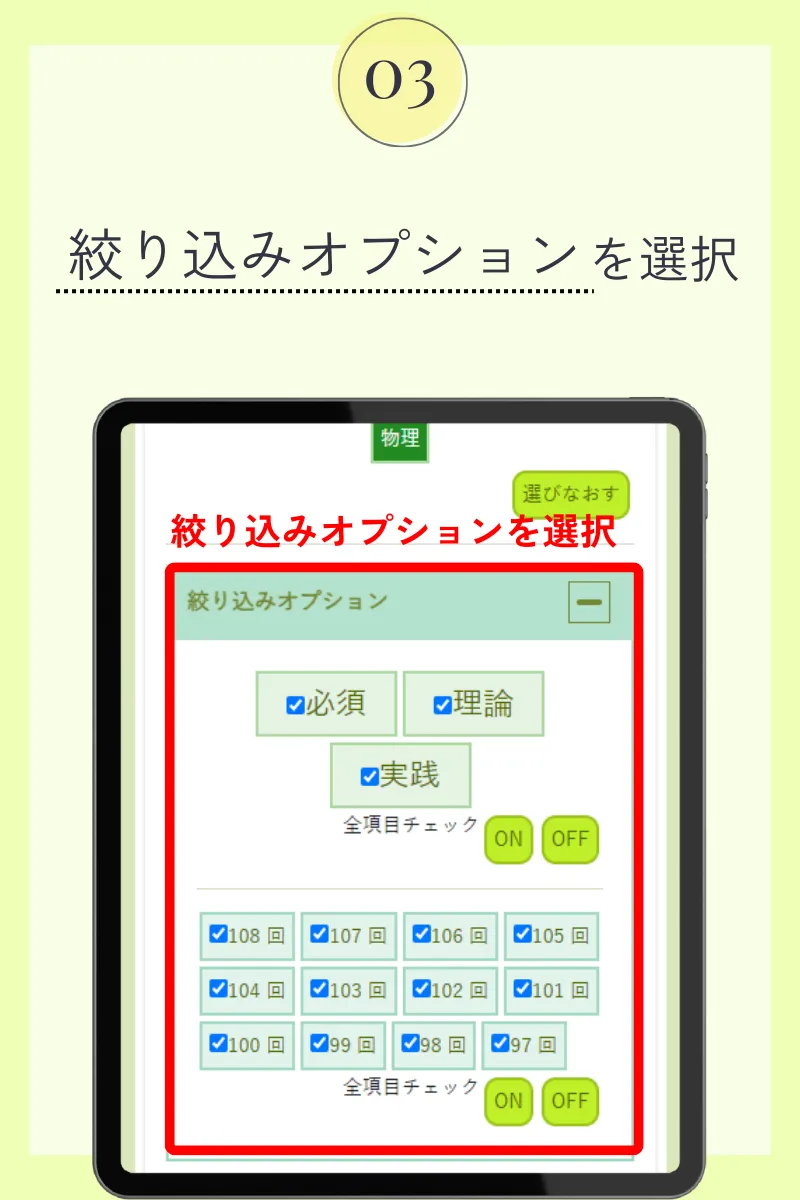
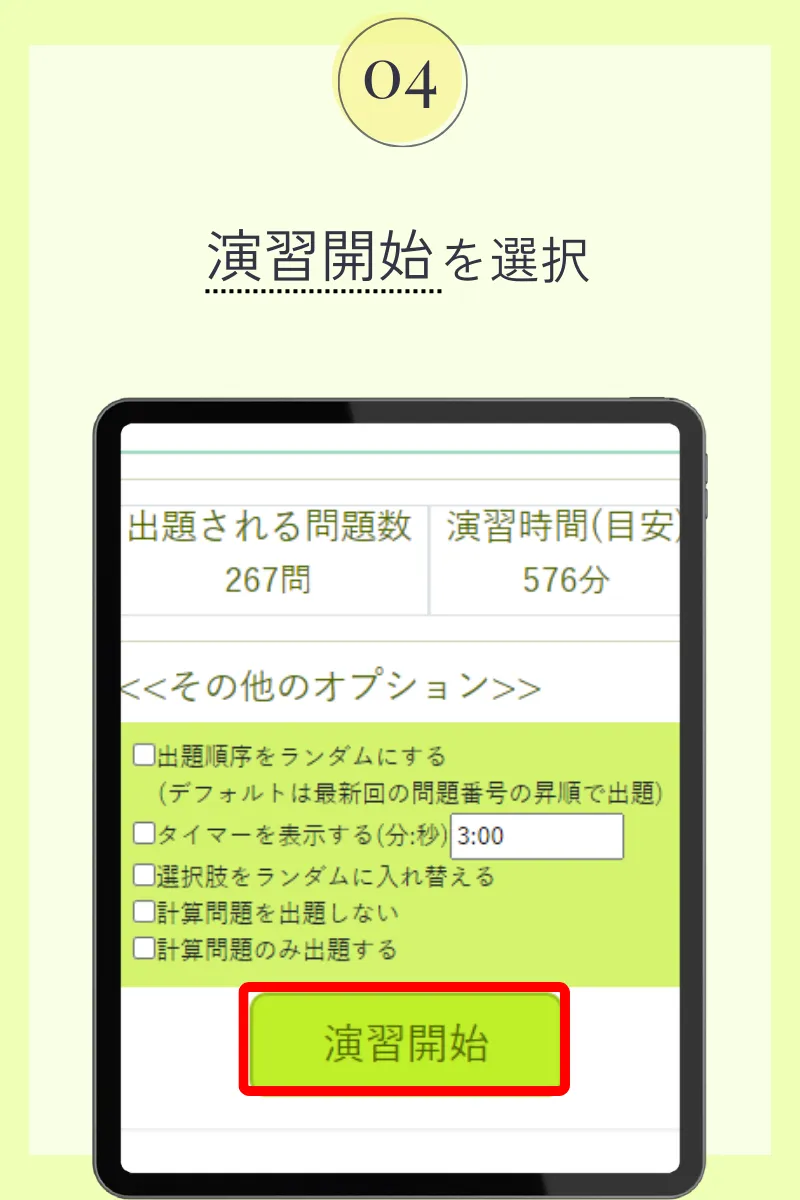
第105回薬剤師国家試験
◆ 問96
0.100mol/Lリン酸二水素一ナトリウム水溶液10.00mLを0.100mol/L水酸化ナトリウム水溶液で中和滴定する。この滴定に関する記述のうち、正しいのはどれか。2つ選べ。ただし、リン酸は三塩基酸でpKa1=2.12、pKa2=7.21、 pKa3=12.32 であり、log102=0.301、log103=0.477とする。-
10.00 mLを正確に量るために、メスピペットが用いられる。
-
滴定前のリン酸二水素一ナトリウム水溶液のpHは約1.6である。
-
水酸化ナトリウム水溶液を9.00 mL 加えたとき、滴定溶液のpH は約8.2である。
-
水酸化ナトリウム水溶液を10.00 mL加えたとき、滴定溶液のpHは約9.8である。
-
この滴定の終点(10.00mL付近)の検出には、pH 指示薬としてメチルオレンジが適している。
◆ 問96
◆領域・タグ
◆正解・解説
正解:3、4
1 誤
滴定では、試料溶液(今回はリン酸二水素一ナトリウム)をホールピペットで正確に量り、コニカルビーカーに入れ、ビュレットより標準液(今回は水酸化ナトリウム)を滴下する。
2 誤
滴定前のリン酸二水素一ナトリウム水溶液では、リン酸二水素一ナトリウムは、H2PO4-として存在する。そのため、滴定前のリン酸二水素一ナトリウム水溶液のpHは約(2.12+7.21)÷2≒4.66となる。
3 正
0.100mol/Lリン酸二水素一ナトリウム水溶液10.00mLに0.100mol/L水酸化ナトリウム水溶液を9.00 mL 加えると、リン酸二水素イオン(H2PO4-)とリン酸水素イオン(HPO42-)が1:9で存在する状態となるため、ヘンダーソン・ハッセルバルヒの式よりpHを計算することができる。
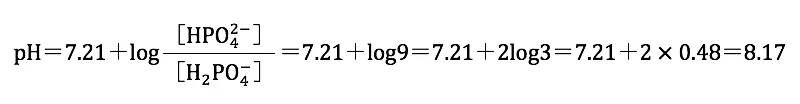
4 正
0.100mol/Lリン酸二水素一ナトリウム水溶液10.00mLに0.100mol/L水酸化ナトリウム水溶液を10.00 mL 加えると、リン酸水素イオン(HPO42-)が存在する状態となる。そのため、水酸化ナトリウム水溶液を10.00 mL加えたとき、滴定溶液のpHはpHは約(7.21+12.32)÷2≒9.8となる。
5 誤
この滴定の終点(10.00mL付近)の検出には、pH 指示薬としてアルカリ性で色が変色するフェノールフタレイン、チモールフタレインが適している。