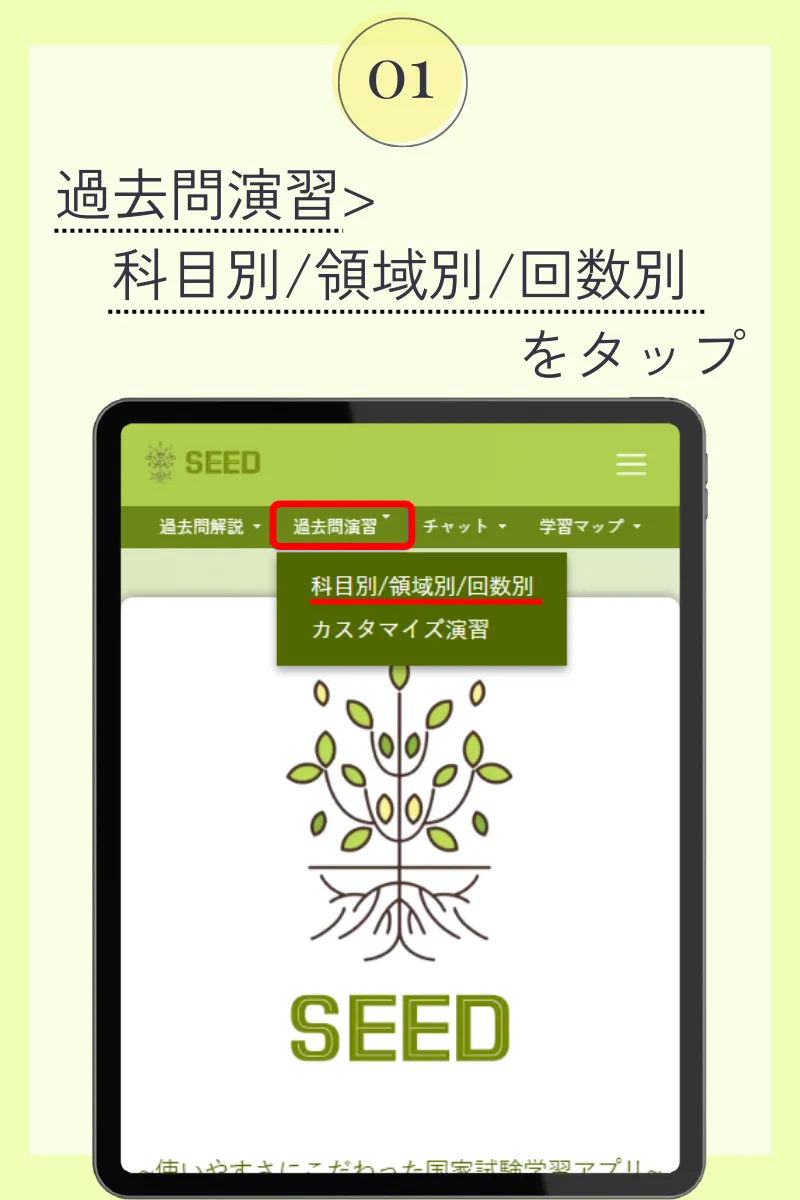
第106回薬剤師国家試験
◆ 問92
前問で調製した1mol/L水酸化ナトリウム液を標定した結果、ファクターは、1.025であった。日本薬局方無水クエン酸(C6H8O7:192.12、下図)適量を水50mLに溶かし、この標準液を用いて滴定した結果、滴定量は 7.85 mLであった(指示薬:フェノールフタレイン試液1滴)。この時、無水クエン酸の量(mg)はいくらか。1つ選べ。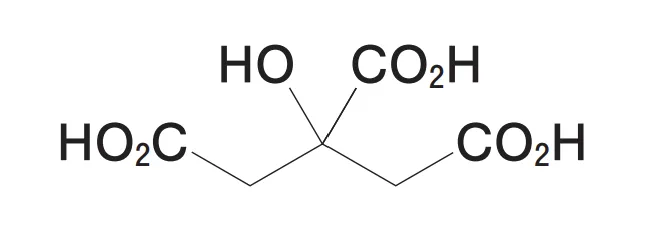
-
4.905×102
-
5.03×102
-
5.15×102
-
1.51×103
-
1.545×103
◆ 問92
◆領域・タグ
◆正解・解説
正解:3
◉対応量(mg)を下記の方法により求めることができる。
対応量:1mol/L水酸化ナトリウム液1mLに相当する無水クエン酸のmg
①:目的成分と標準液がどのように反応するか確認し、目的成分1molに対して、反応する標準液のmol数(対応数)を求める。クエン酸にはCOOHが3つあるため、クエン酸1molに対して水酸化ナトリウムが3mol反応する(対応数:3)。
②:標準液1mLと反応する目的成分の物質量(mmol)を求める。

③:対応量(mg)を求める。
対応量(mg)=②で求めた目的成分の物質量(mmol)×目的成分の分子量
=1/3×192.12=64.04 mg
◉直接滴定による「含量」は次式で求めることができる
含量=対応量×標準液の消費量×ファクター
=64.04×7.85×1.025=515.28≒5.15×102