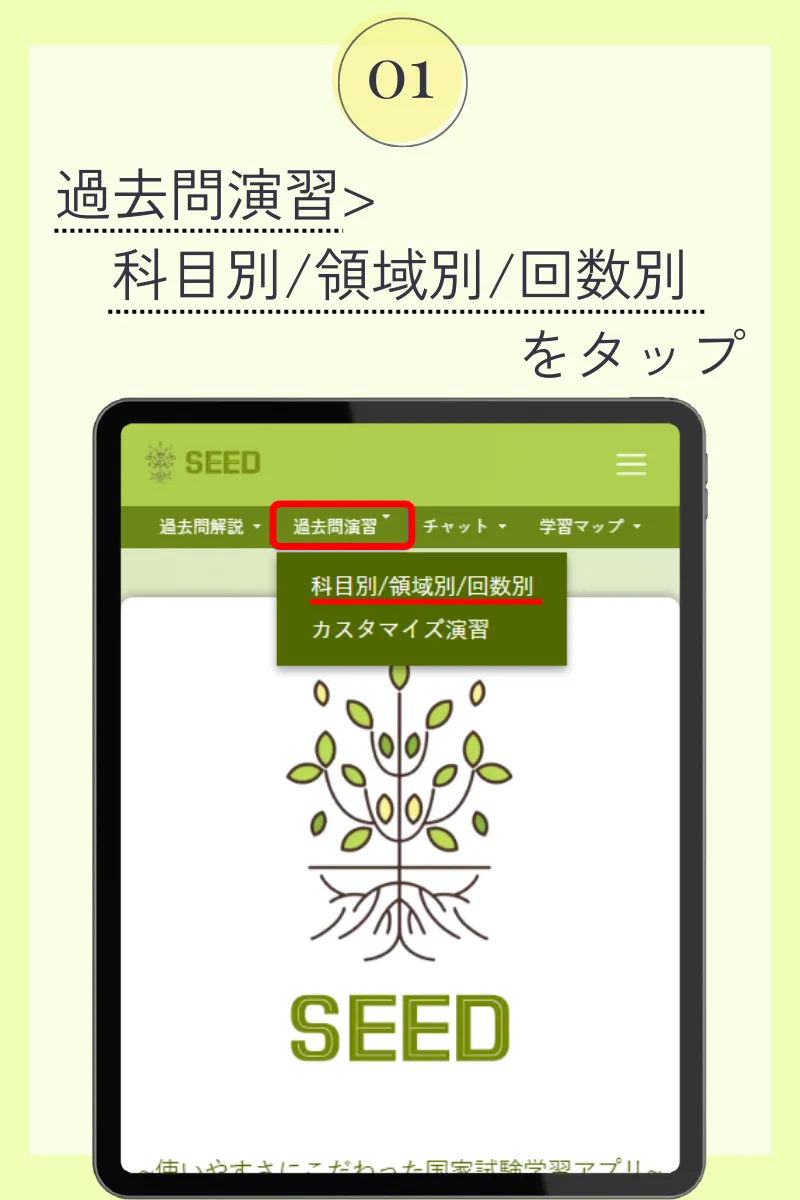
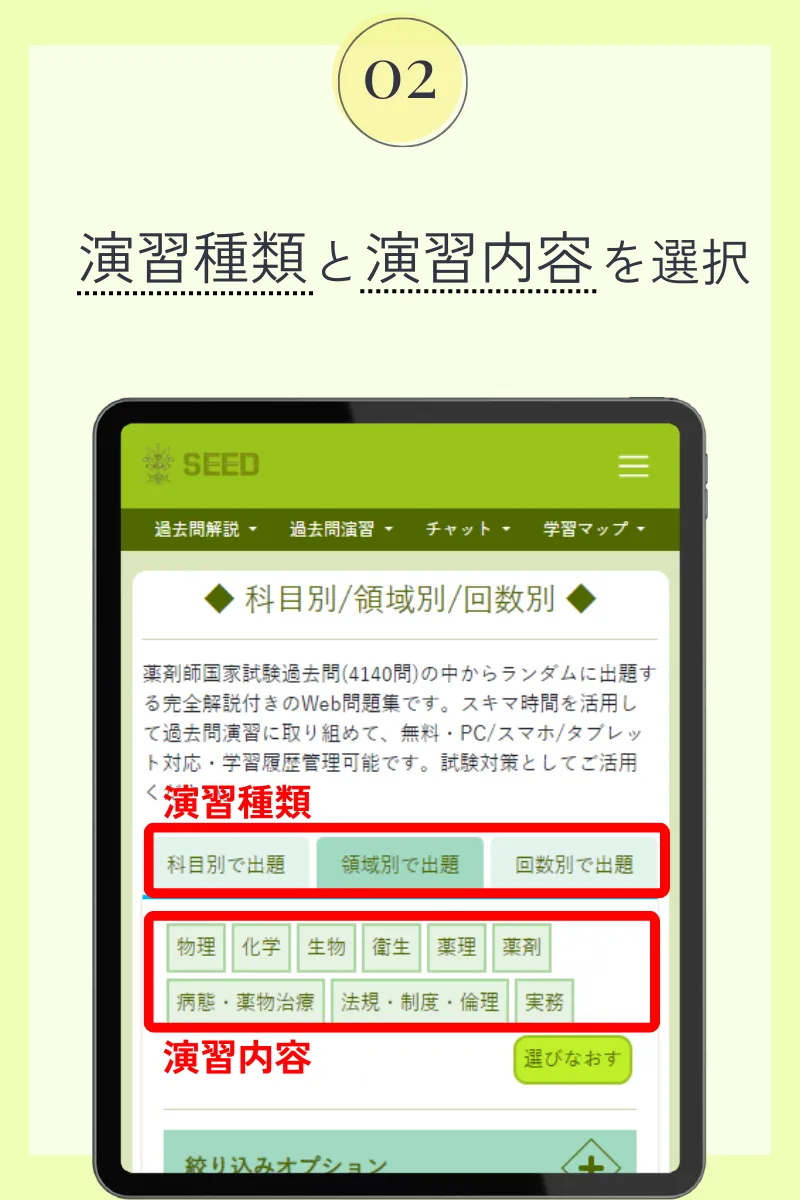
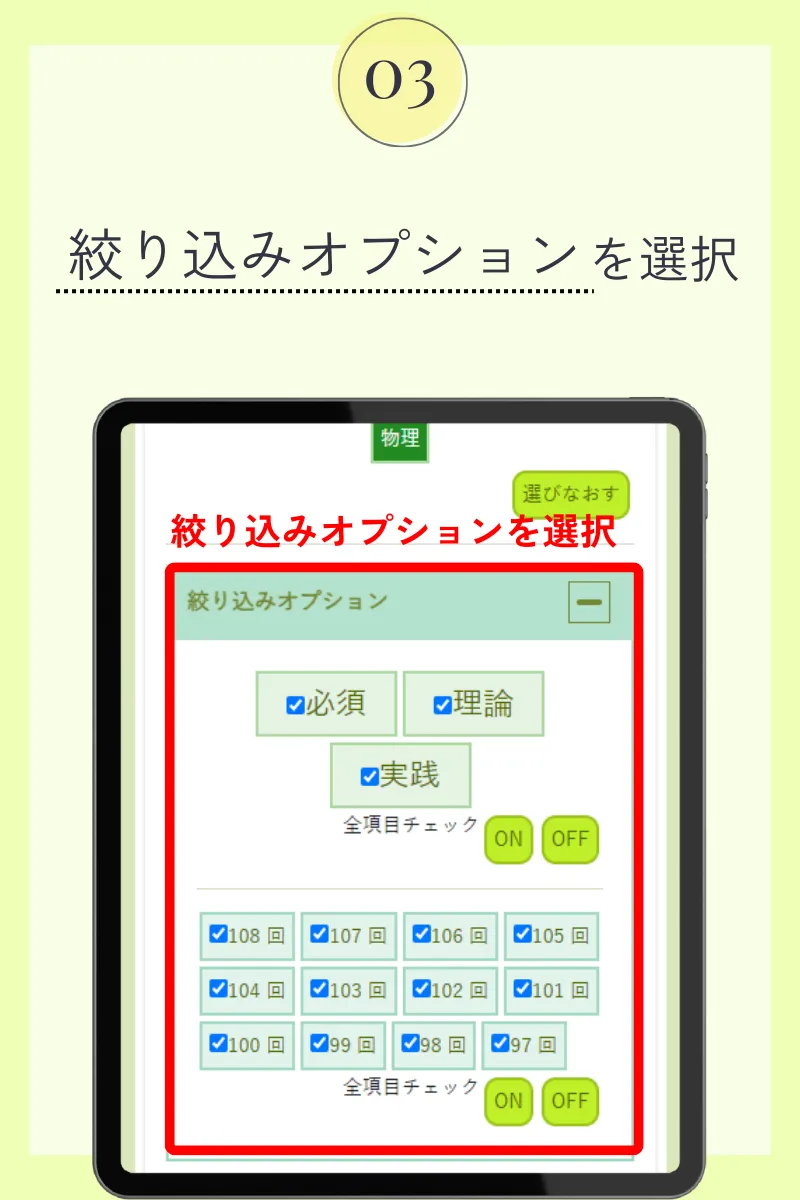
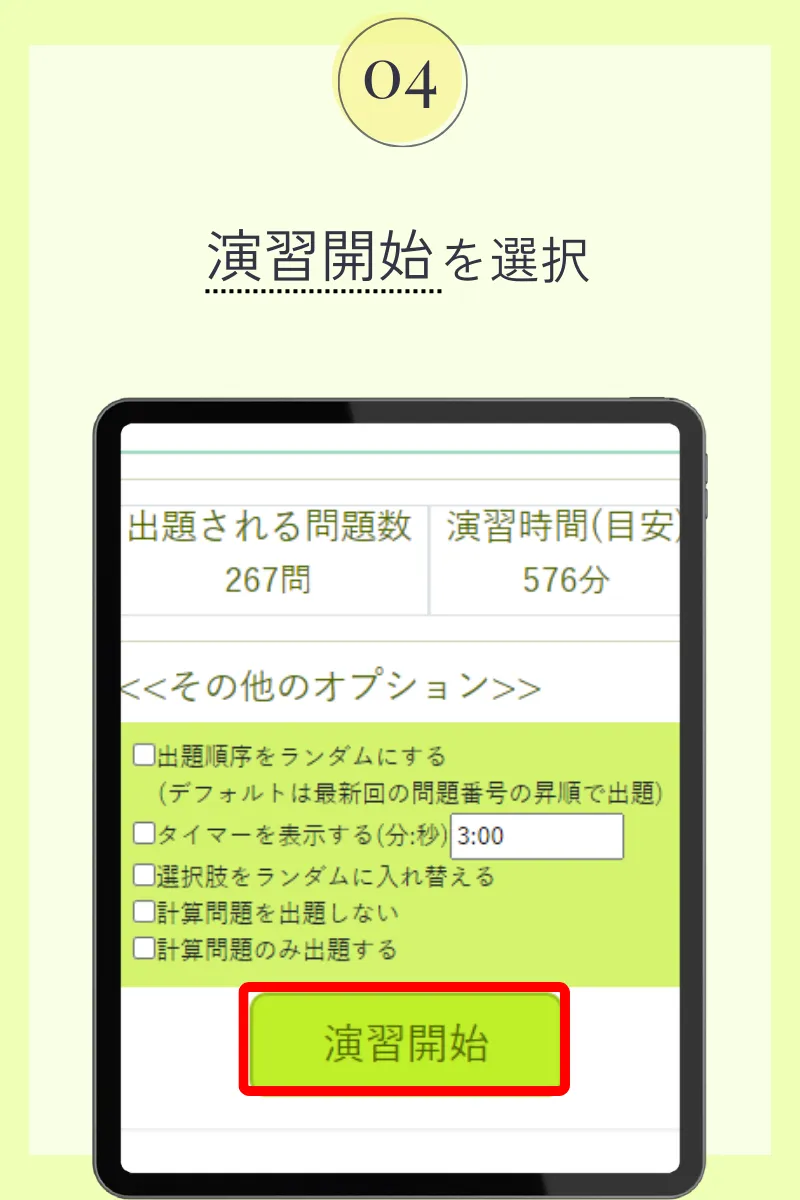
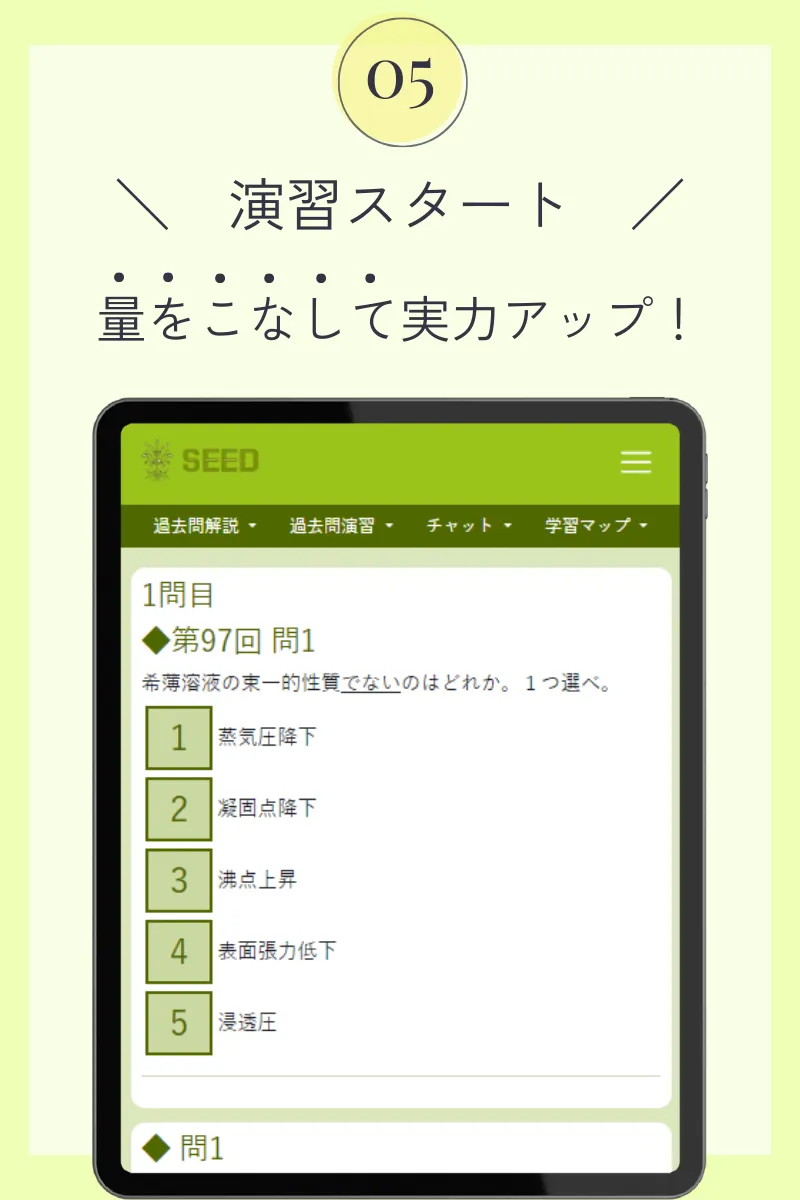
第107回薬剤師国家試験
◆ 問1
0.010 mol/L水酸化ナトリウム水溶液のpHとして最も近い値はどれか。1つ選べ。 ただし、水のイオン積 Kw =[H+][OH-] = 1.0 × 10-14(mol/L) 2とする。-
1
-
2
-
7
-
12
-
13
◆ 問1
◆領域・タグ
◆正解・解説
正解:4
水酸化ナトリウムは強塩基であり、水中で完全に解離するため、水酸化ナトリウム水溶液中の[OH-]は0.010 (10-2)mol/Lとなる。また、水のイオン積 Kw = Kw =[H+][OH-] = 1.0 × 10-14(mol/L)2であることから水酸化ナトリウム水溶液中の[H+]は1.0 × 10-12(mol/L)となる。
よって、0.010 mol/L水酸化ナトリウム水溶液のpHは、-log[H+]=-log[1.0 × 10-12]=12となる。