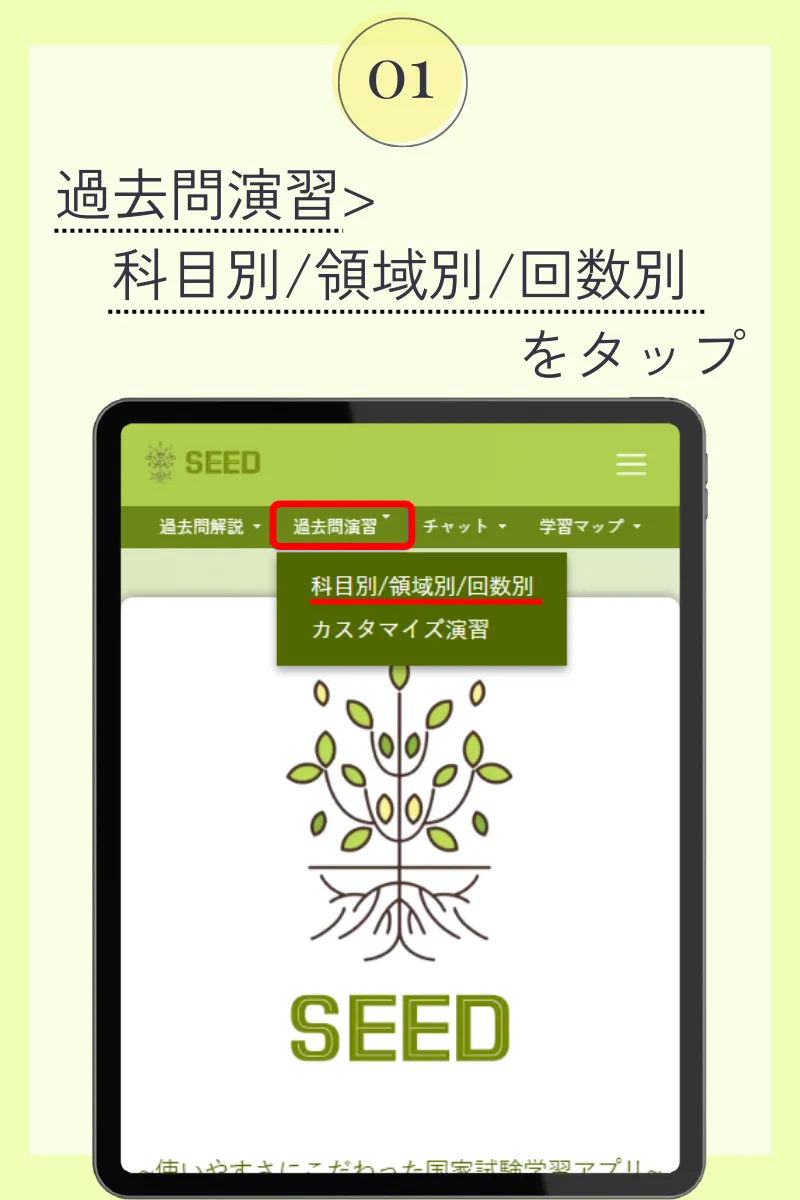
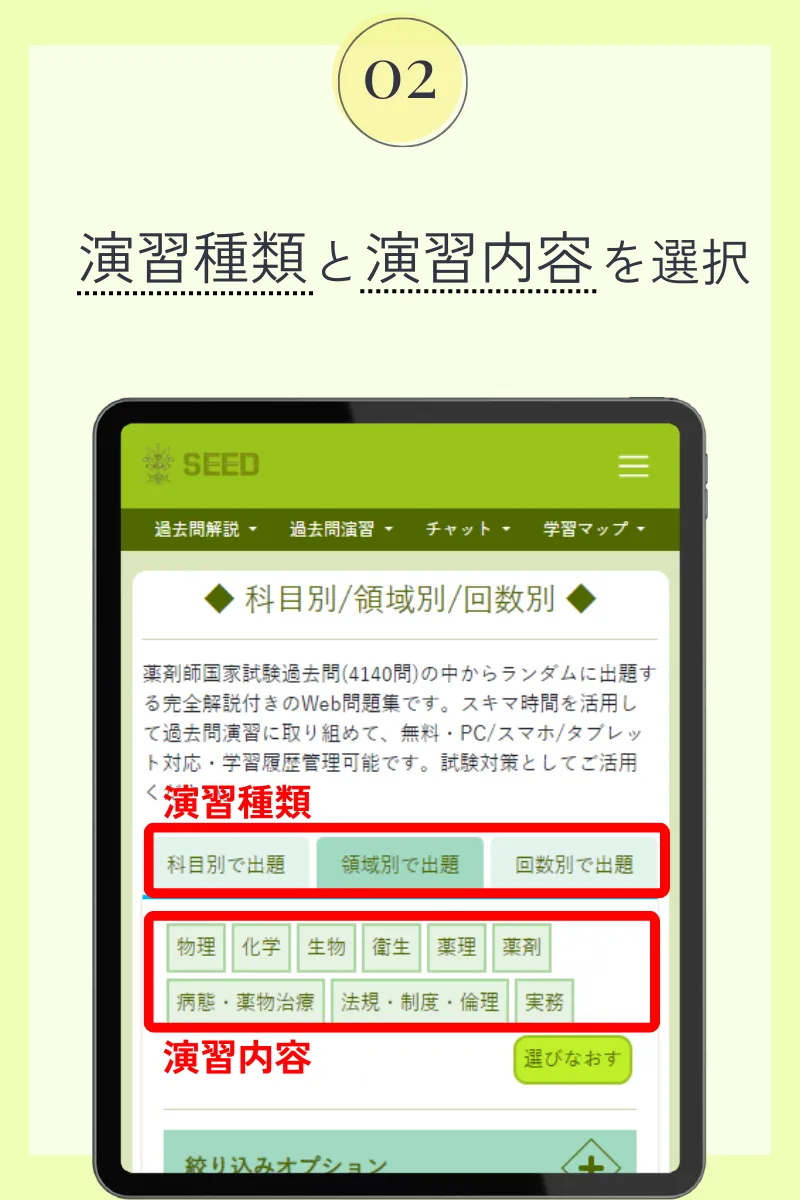
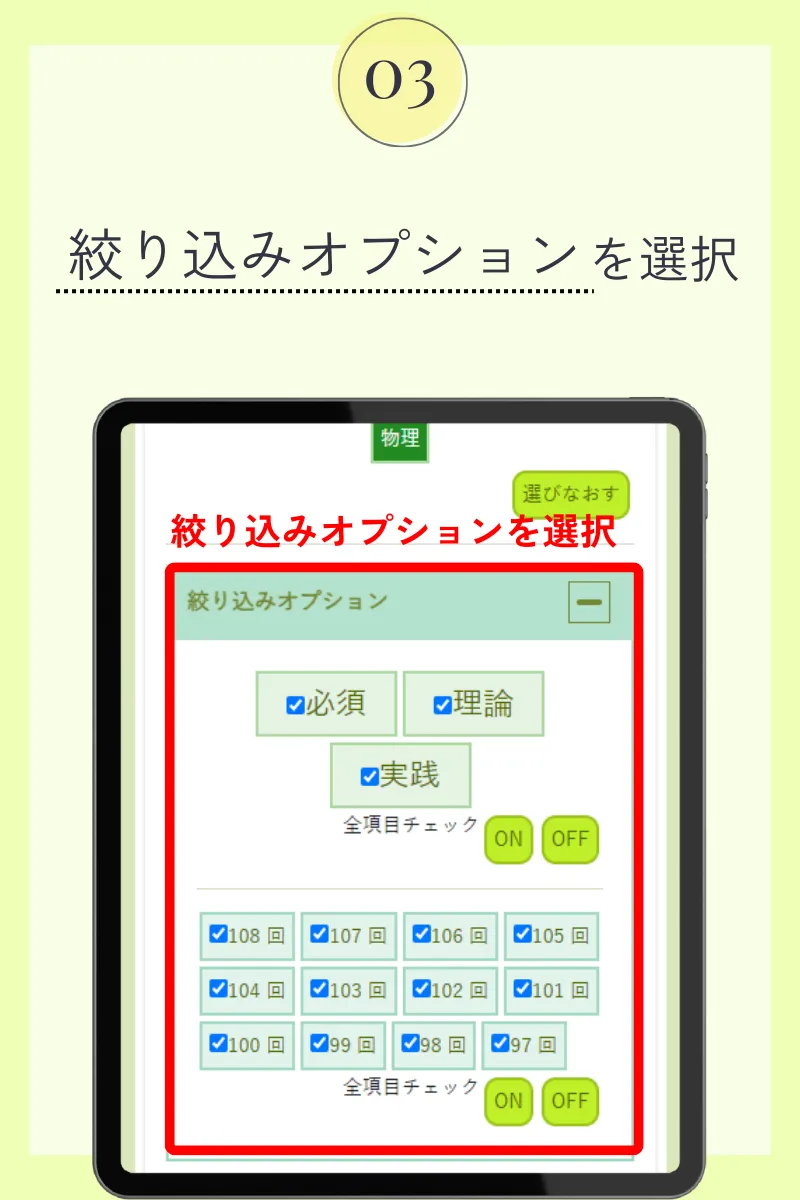
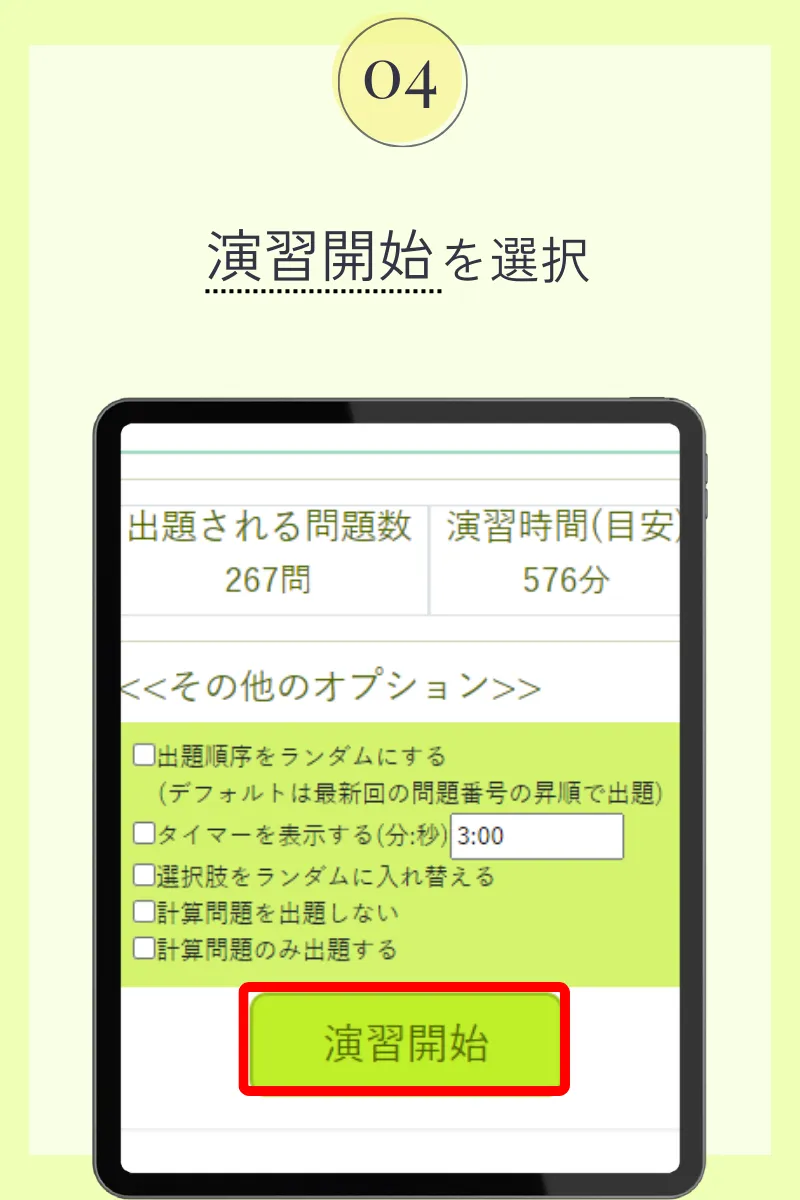
第107回薬剤師国家試験
◆ 問4
0.10mol/L硫酸ナトリウム水溶液中における硫酸バリウムの溶解度に最も近いのはどれか。1つ選べ。 ただし、温度は25℃とし、同温度における硫酸バリウムの溶解度積を1.0×10-10(mol/L)2とし、硫酸バリウムの溶解による体積変化は無視できるものとする。-
1.0×10-19 moL/L
-
1.0×10-11 moL/L
-
1.0×10-9 moL/L
-
1.0×10-5 moL/L
-
1.0×10-4 moL/L
◆ 問4
◆領域・タグ
◆正解・解説
正解:3
硫酸バリウムは2価の陽イオン(Ba2+)と2価の陰イオン(SO42-)からなる難溶解性物質であることから、溶解度積Kspは[Ba2+][SO42-]となる。また、硫酸ナトリウムは強電解質であり、水溶液中で完全に解離することから、0.10mol/L硫酸ナトリウム水溶液中における[SO42-]は0.10mol/Lとなる(硫酸バリウムから発生するSO42-も存在するが、硫酸ナトリウムから生成するに比べてごく微量であるため、計算する際無視することができる)。
上記のことに加え、硫酸バリウムの溶解度積が1.0×10-10であることから、0.10mol/L硫酸ナトリウム水溶液中で存在する[Ba2+]は1.0×10-9mol/Lとなる。[Ba2+]は、硫酸バリウムの溶解度と等しいため、0.10mol/L硫酸ナトリウム水溶液中における硫酸バリウムの溶解度は、1.0×10-9mol/Lとなる。