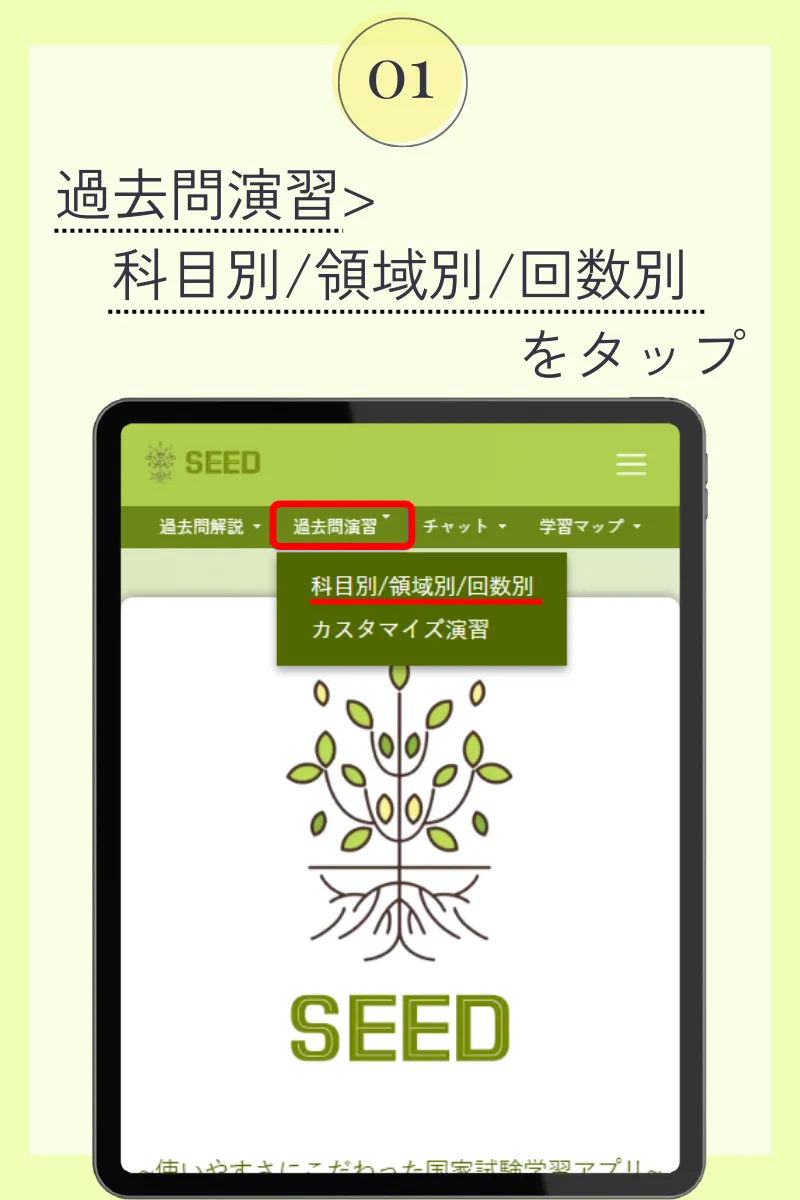
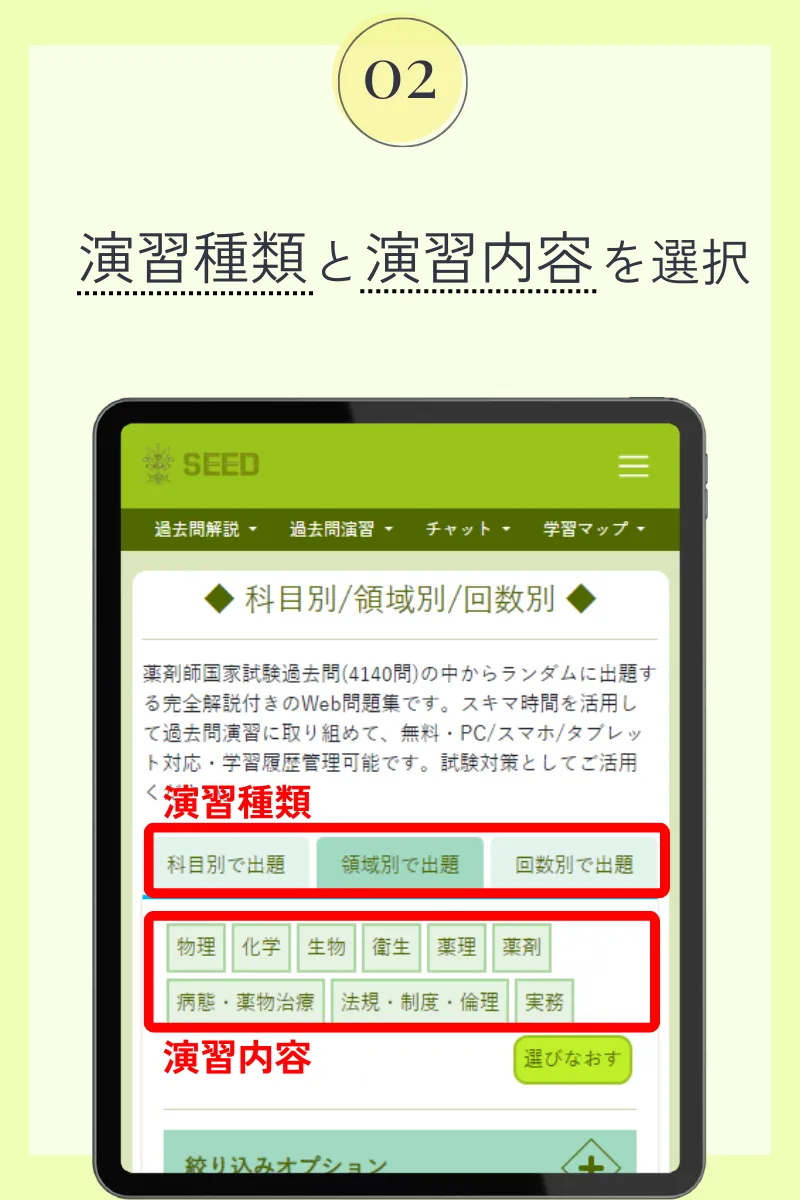
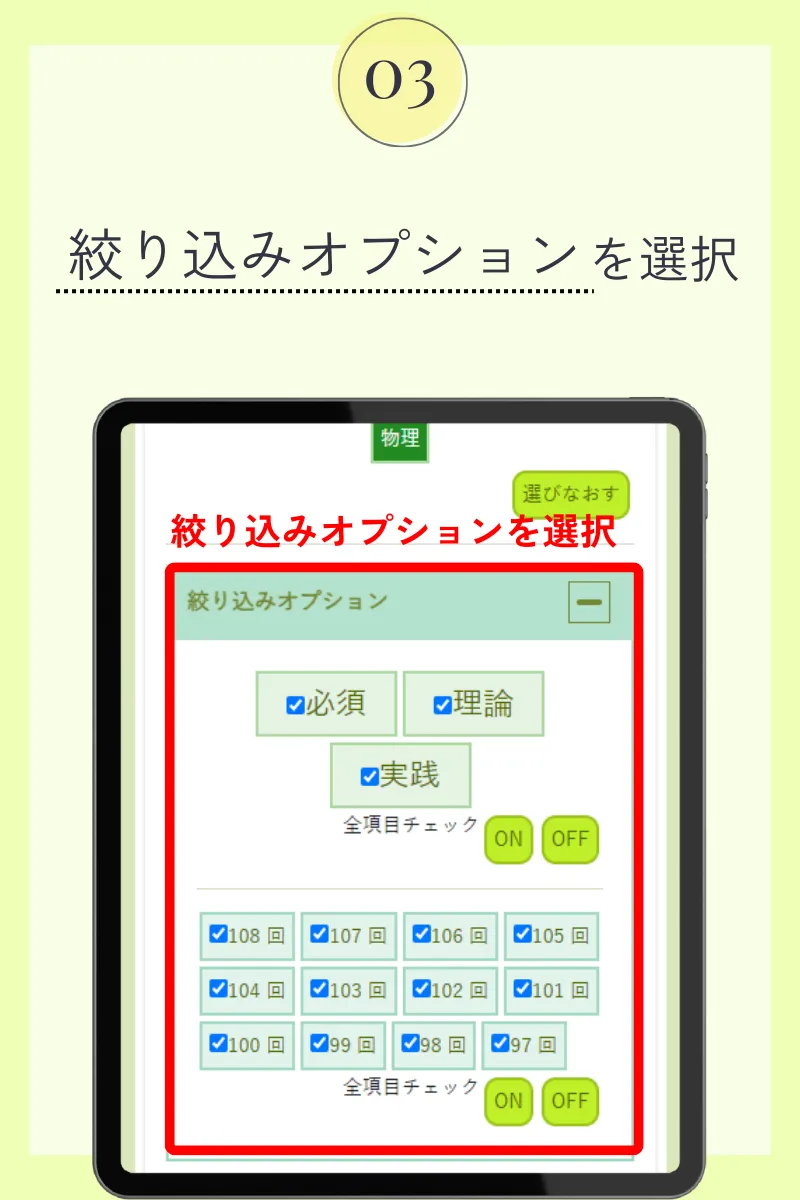
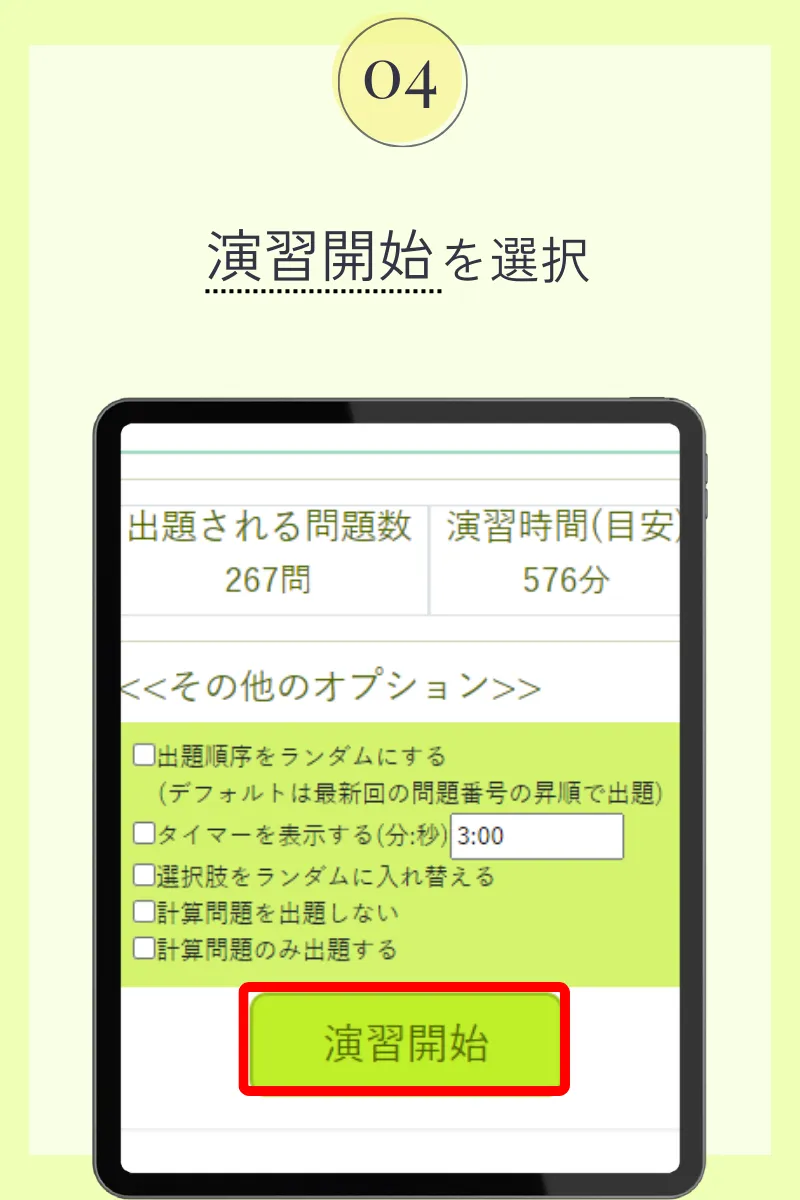
第108回薬剤師国家試験
◆ 問93
酸化還元反応と化学電池に関する記述のうち、正しいのはどれか。2つ選べ。-
酸化還元反応において、電子を受け取るのは還元剤である。
-
コハク酸(C4H6O4)+ FAD フマル酸(C4H4O4)+ FADH2 の反応において、コハク酸は酸化剤である。
-
進行中の酸化還元反応の起電力は、Henderson‒Hasselbalch の式で表すことができる。
-
電解質の濃度のみが異なる2つの半電池からなる化学電池(濃淡電池)の標準起電力は0Vである。
-
反応が自発的に進行している化学電池では、カソード(正極)で還元反応が起こる。
◆ 問93
◆領域・タグ
◆正解・解説
正解:4、5
酸化還元反応と化学電池に関する正しい記述を選ぶ問題です。それぞれの選択肢について解説します。
「酸化還元反応において、電子を受け取るのは還元剤である。」
酸化還元反応では、酸化剤が電子を受け取り、還元剤が電子を提供するという役割分担があります。したがって、この記述は正しいです。
「コハク酸(C4H6O4)+ FAD フマル酸(C4H4O4)+ FADH2 の反応において、コハク酸は酸化剤である。」
この反応式を見ると、コハク酸がフマル酸に変わる過程で電子を失っていることがわかります。電子を失うことは酸化を意味するため、コハク酸は酸化剤です。したがって、この記述も正しいです。
「進行中の酸化還元反応の起電力は、Henderson‒Hasselbalch の式で表すことができる。」
Henderson‒Hasselbalch の式は、酸と塩基の解離平衡を表すための式であり、酸化還元反応の起電力とは直接関係ありません。したがって、この記述は誤っています。
「電解質の濃度のみが異なる2つの半電池からなる化学電池(濃淡電池)の標準起電力は0Vである。」
濃淡電池は、電解質の濃度の差を利用して電気エネルギーを生成する装置です。濃淡電池では、電解質の濃度の差が起電力になりますが、この起電力が0Vである場合、濃淡電池は動作しません。したがって、この記述は正しいです。
「反応が自発的に進行している化学電池では、カソード(正極)で還元反応が起こる。」
化学電池では、酸化反応がアノード(負極)で起こり、還元反応がカソード(正極)で起こります。自発的に進行している化学電池では、カソードでの還元反応が起こっているため、この記述は正しいです。
したがって、正しい記述は「電解質の濃度のみが異なる2つの半電池からなる化学電池(濃淡電池)の標準起電力は0Vである。」「反応が自発的に進行している化学電池では、カソード(正極)で還元反応が起こる。」の2つです。