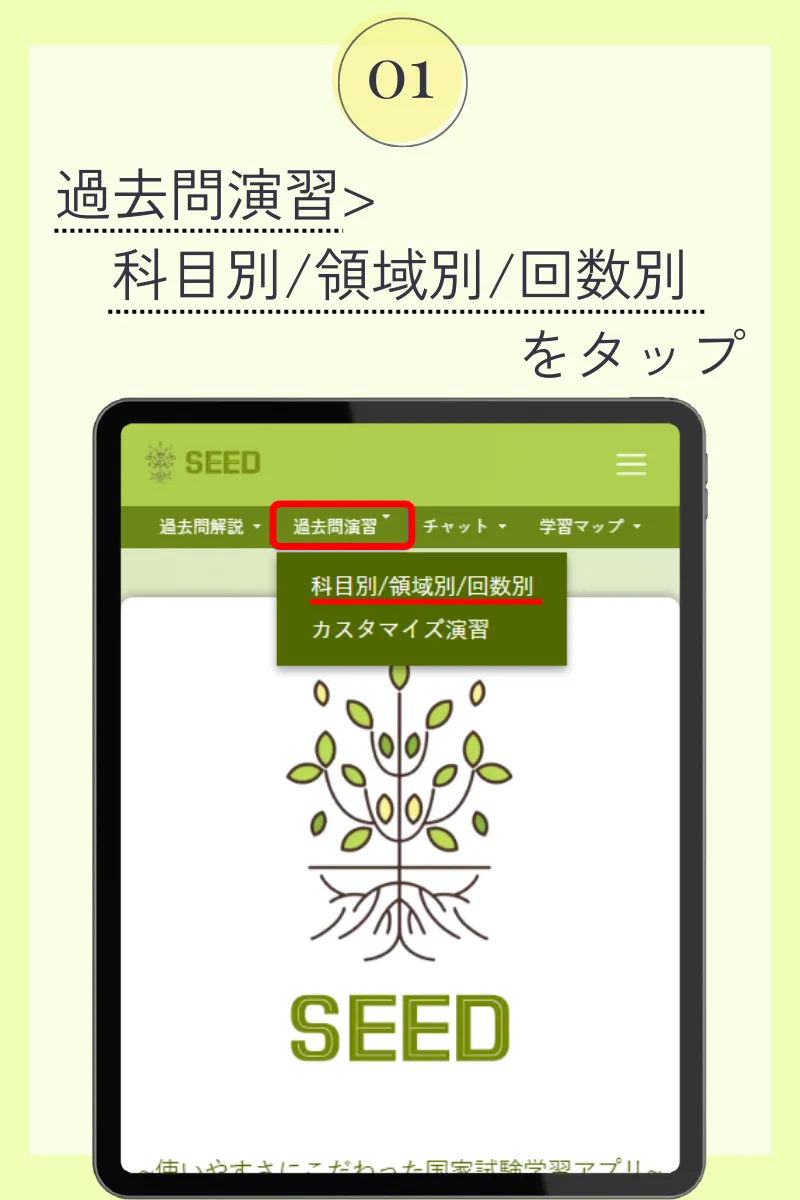
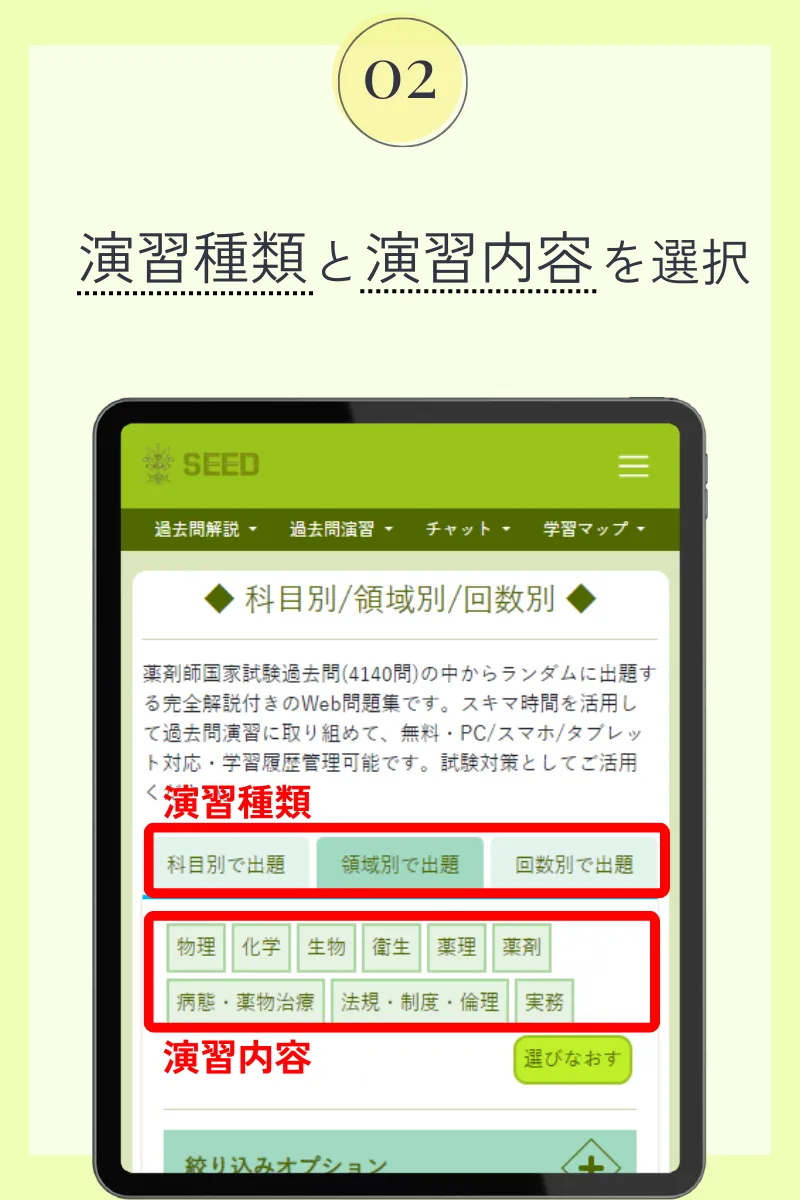
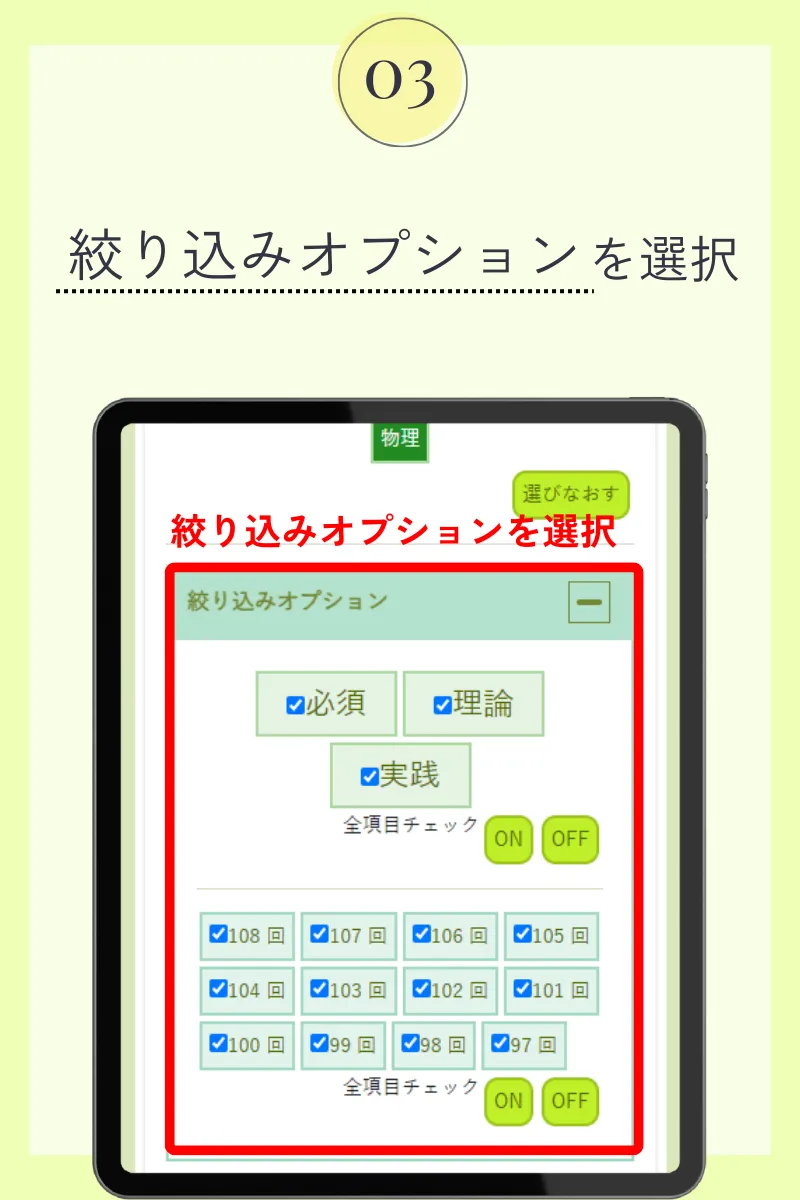
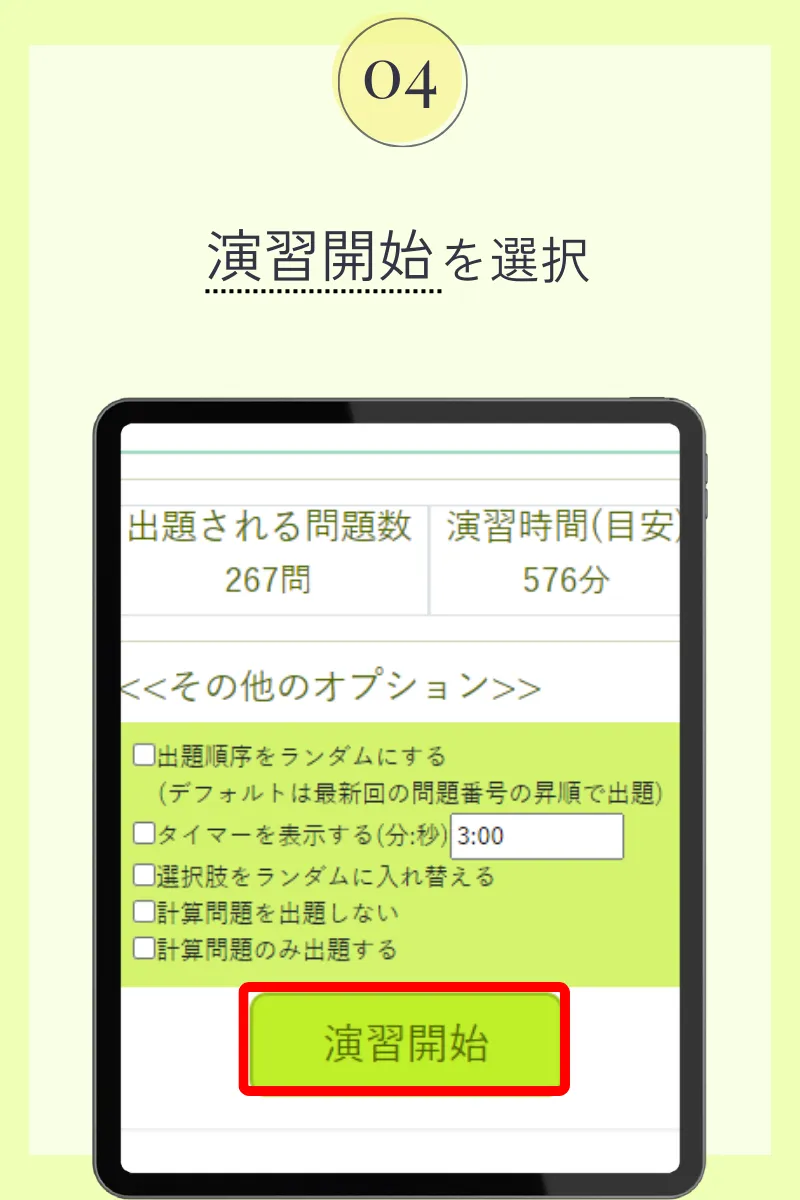
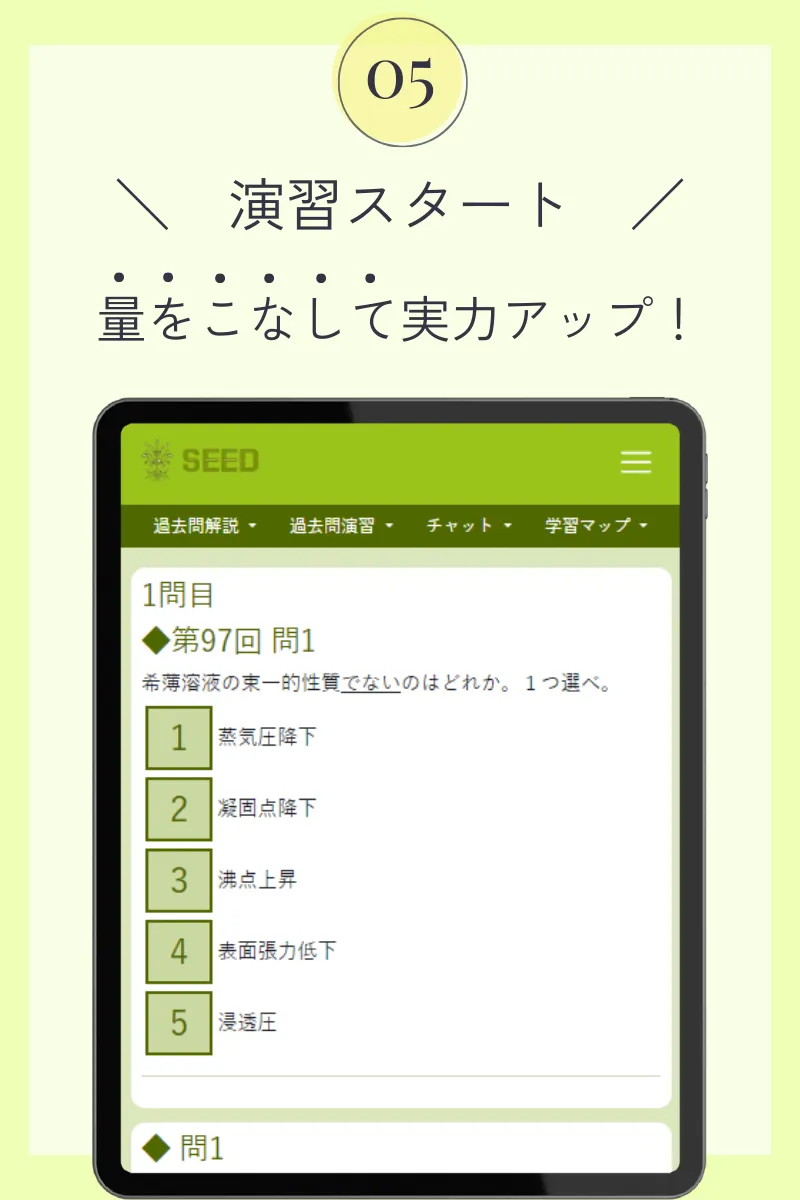
第108回薬剤師国家試験
◆ 問95
0.20mol/L塩化アンモニウム水溶液100mLを用いてアンモニア・塩化アンモニウム緩衝液(pH9.0)を調製したい。この塩化アンモニウム水溶液に加える0.18mol/Lアンモニア水溶液の液量に最も近い値はどれか。1つ選べ。ただし、アンモニアのpKb=4.7、水のイオン積[H+][OH-]=1.0×10-14(mol/L)2、100.3=2とし、混合により各水溶液の体積は変化しないものとする。
-
15ml
-
35ml
-
55ml
-
75ml
-
95ml
◆ 問95
◆領域・タグ
◆正解・解説
正解:3
Henderson-Hasselbalch (ヘンダーソン-ハッセルバルヒ)の式から以下のように表せます。
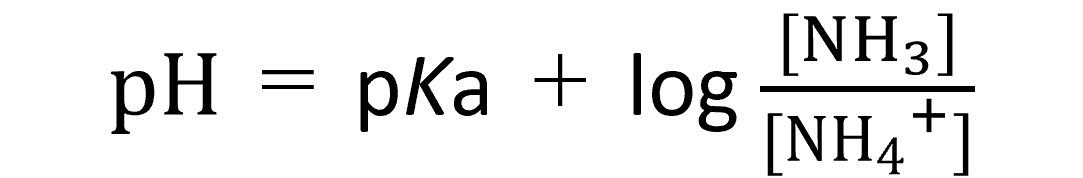
アンモニアの pKb=4.7とあるので、
pKa+pKb=14よりpKa=14ー4.7=9.3と計算出来ます。
また、本緩衝液中に含まれるアンモニウムイオン(NH4+)は
0.20mol/L×0.1L=0.02mol存在することが分かります。
ここまででpH=9.0、pKa=9.3、[NH4+]=0.02を上記の式に代入すると以下のようになります。
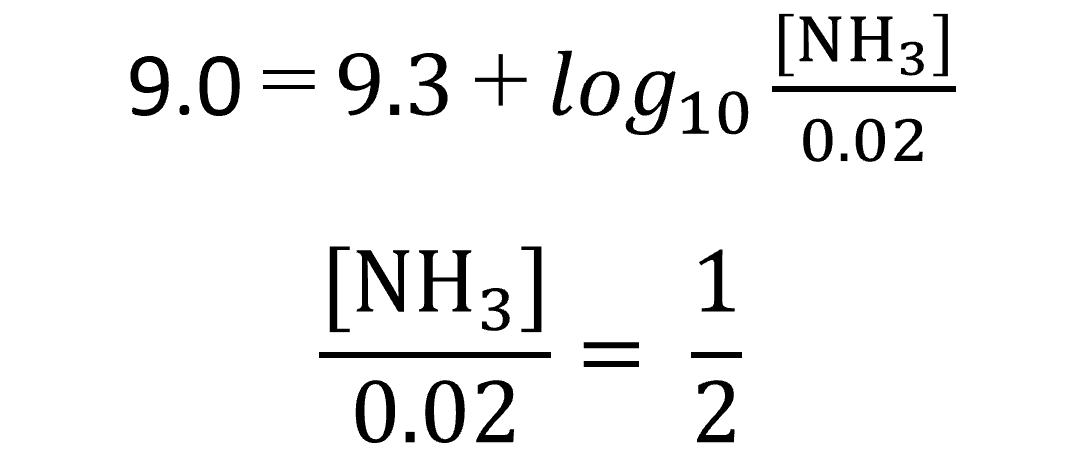
つまり、[NH3]=0.01molであることが分かります。
0.18 mol/L×○mL=0.01mol との計算式から
○mL≒55.5mLであると分かります。
答えは「55mL」です。