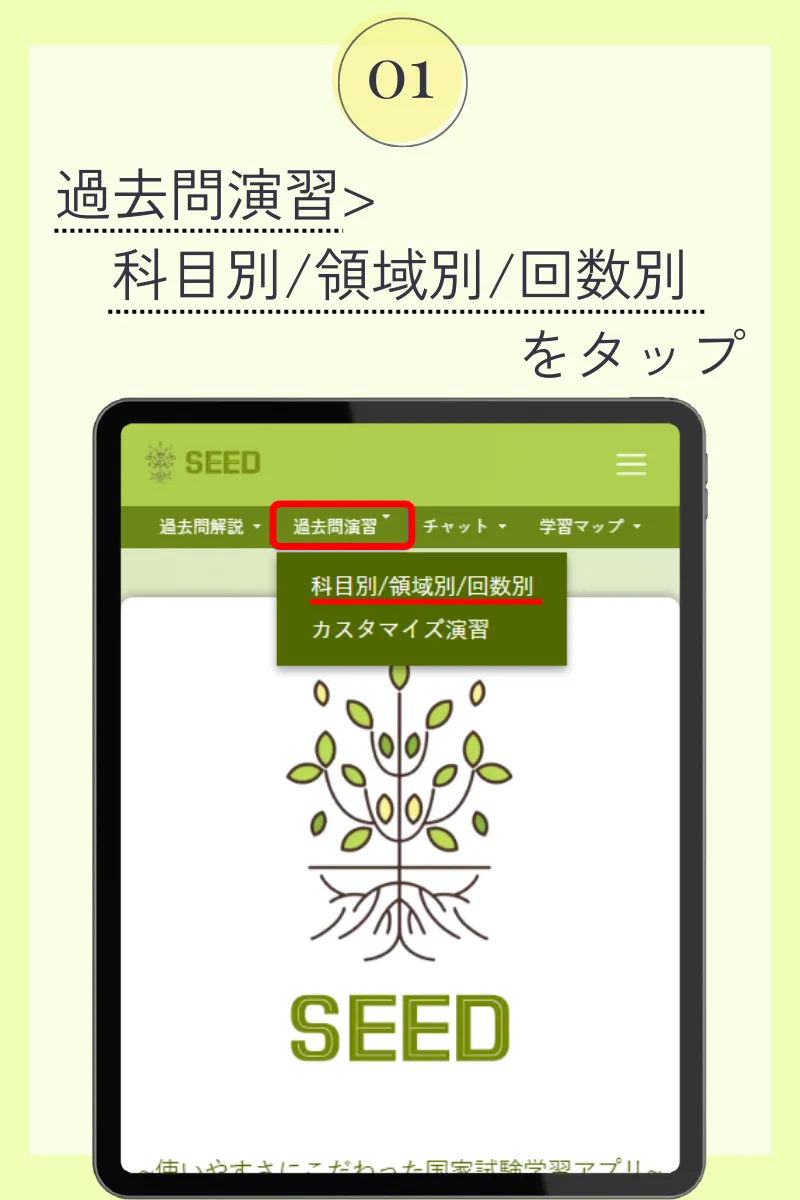
第109回薬剤師国家試験
◆ 問182
バイオ医薬品の微粒子製剤の水への分散性を、ゼータ電位と平均粒子径から評価した。下図の異なるpHにおける結果に関する記述のうち、正しいのはどれか。2つ選べ。ただし、一次粒子の粒子径はpHにより変化せず、温度は一定とする。また、粒度分布は一峰性で十分小さく、粒子の凝集は可逆的とする。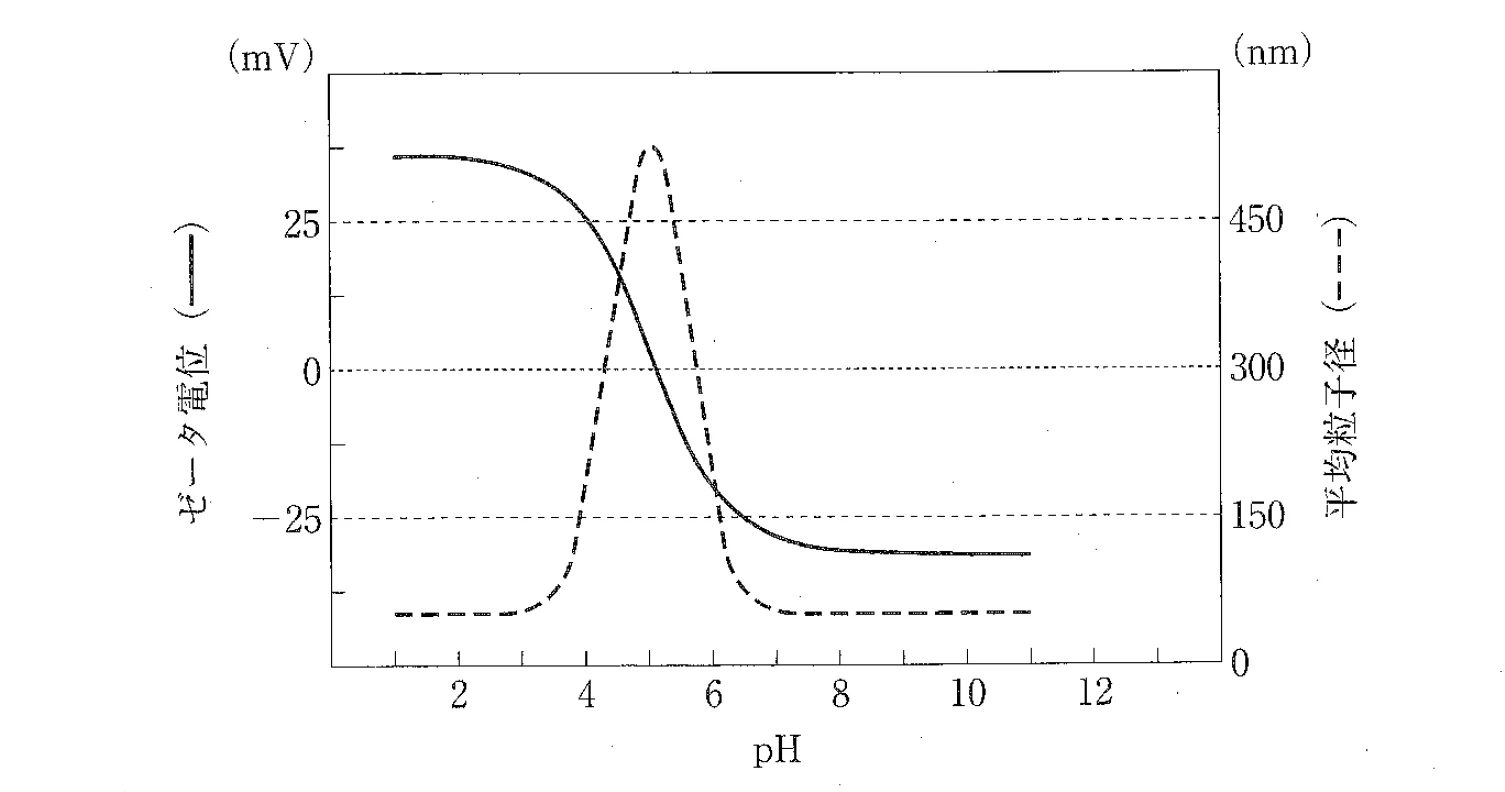
-
pH2で分散粒子は正に帯電している。
-
pH5付近で最も凝集性が高い。
-
pH6付近で粒子表面は電気的に中性である。
-
pH8以上で粒子は凝析している。
-
塩を加えることでpHによらず分散性を改善できる。
◆ 問182
◆領域・タグ
◆正解・解説
正解:1、2
正解の選択肢についての解説は以下の通りです。
[ pH2で分散粒子は正に帯電している。]
正しいです。ゼータ電位が正の値を示しているため、pH2では分散粒子が正に帯電しています。ゼータ電位は粒子の表面電荷の指標であり、正の値は粒子が正の電荷を持っていることを意味します。
[ pH5付近で最も凝集性が高い。]
正しいです。ゼータ電位が0に近い値を示すと、粒子間の静電的反発が減少し、凝集しやすくなります。pH5付近でゼータ電位が最も低い(0に近い)ため、このpHでは凝集性が最も高くなります。
間違った選択肢についての解説は以下の通りです。
[ pH6付近で粒子表面は電気的に中性である。]
誤りです。ゼータ電位が負の値を示しているため、pH6では粒子表面が負に帯電しています。
[ pH8以上で粒子は凝析している。]
誤りです。ゼータ電位が負のままであるため、粒子は静電的反発によって安定しており、凝析は起こりにくいです。
[ 塩を加えることでpHによらず分散性を改善できる。]
誤りです。この情報はグラフからは得られませんが、一般に塩を加えるとイオン強度が増し、粒子間の静電的相互作用が遮蔽され、凝集が促進されることがあります。
覚えておくべき用語:
ゼータ電位:粒子の表面電荷を示す指標で、分散系の安定性を評価するために使用されます。
凝集:粒子が集まって大きな塊を形成すること。
凝析:粒子が化学的または物理的な変化を経て、分散系から分離すること。