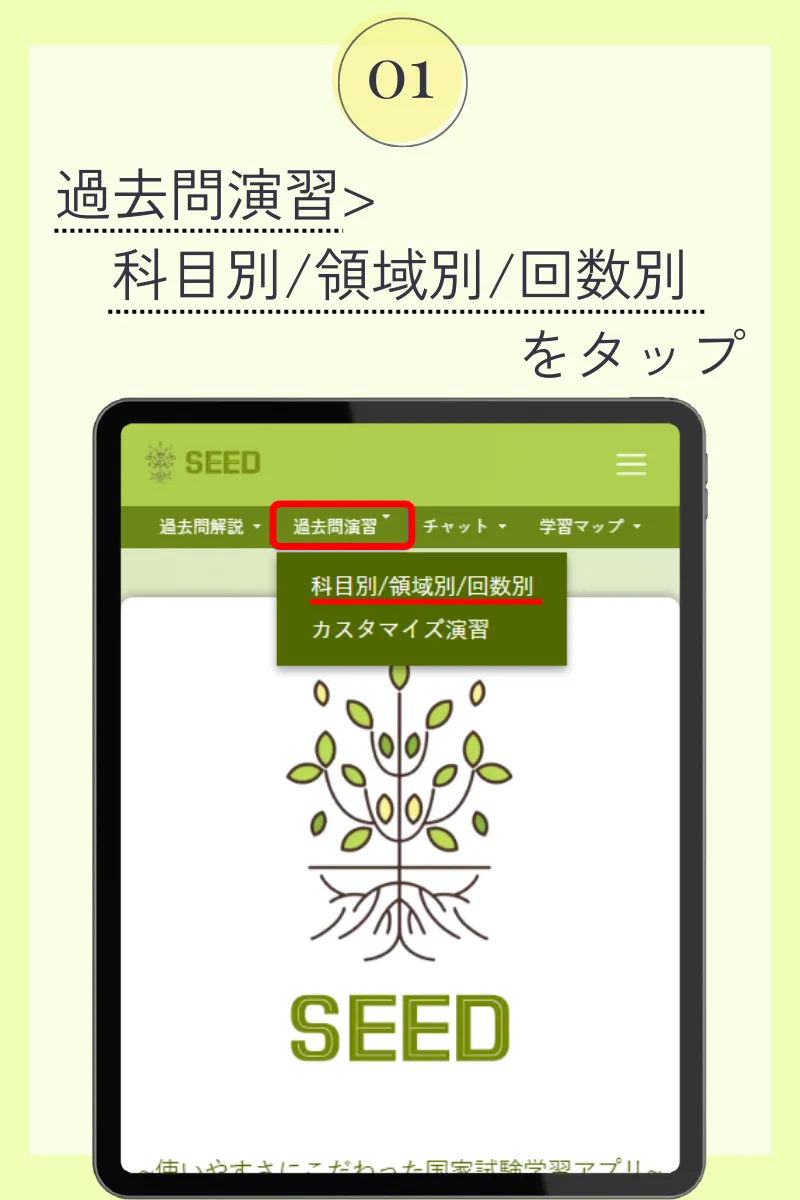
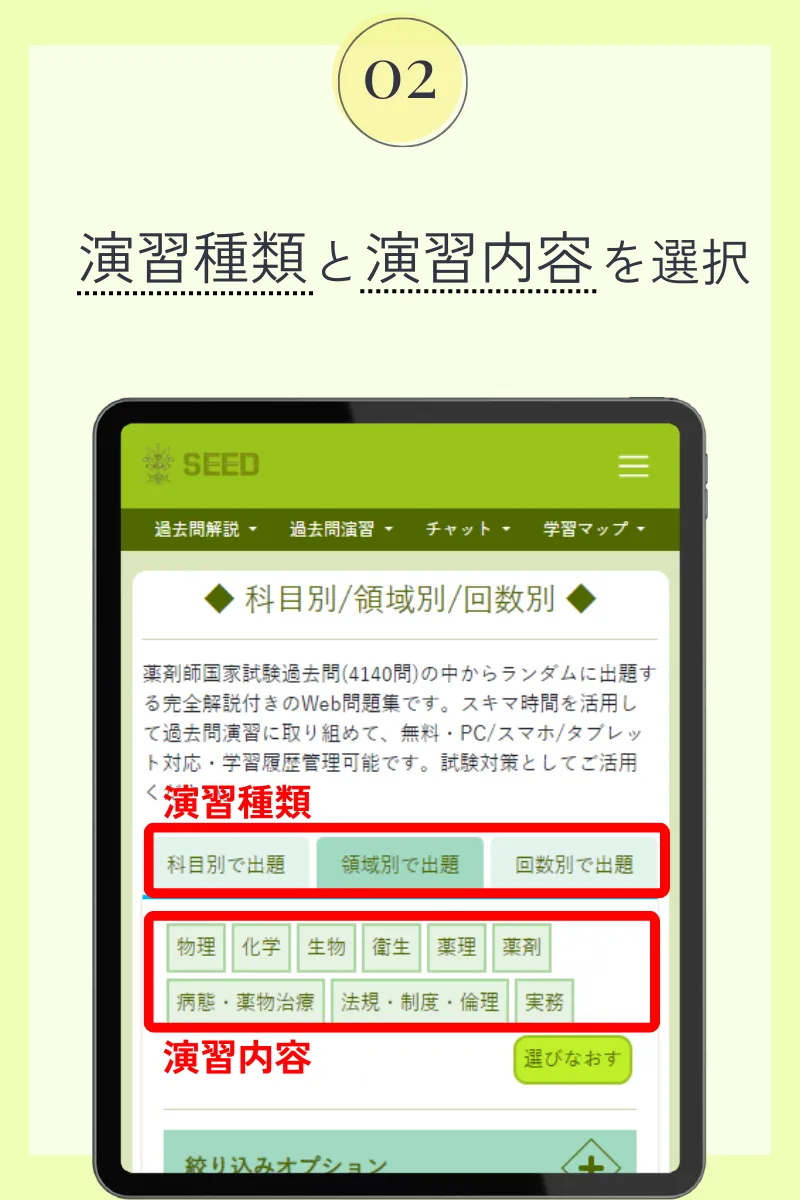
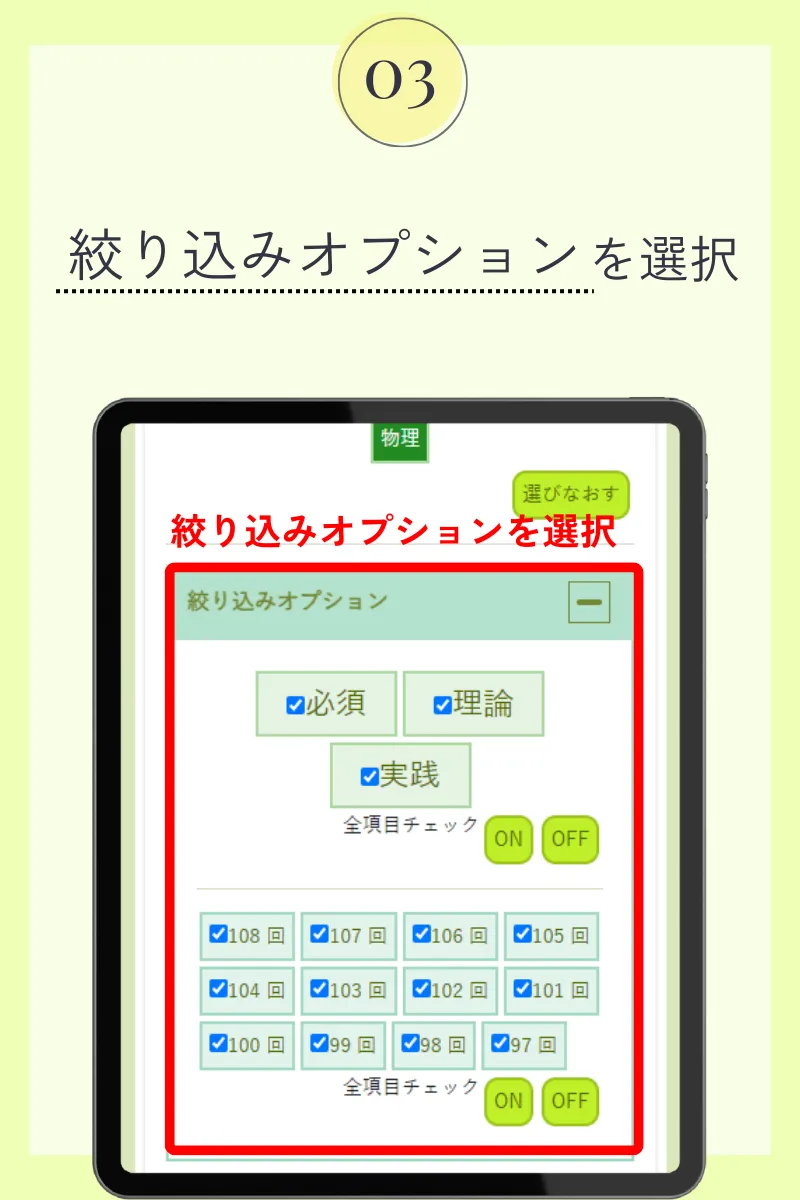
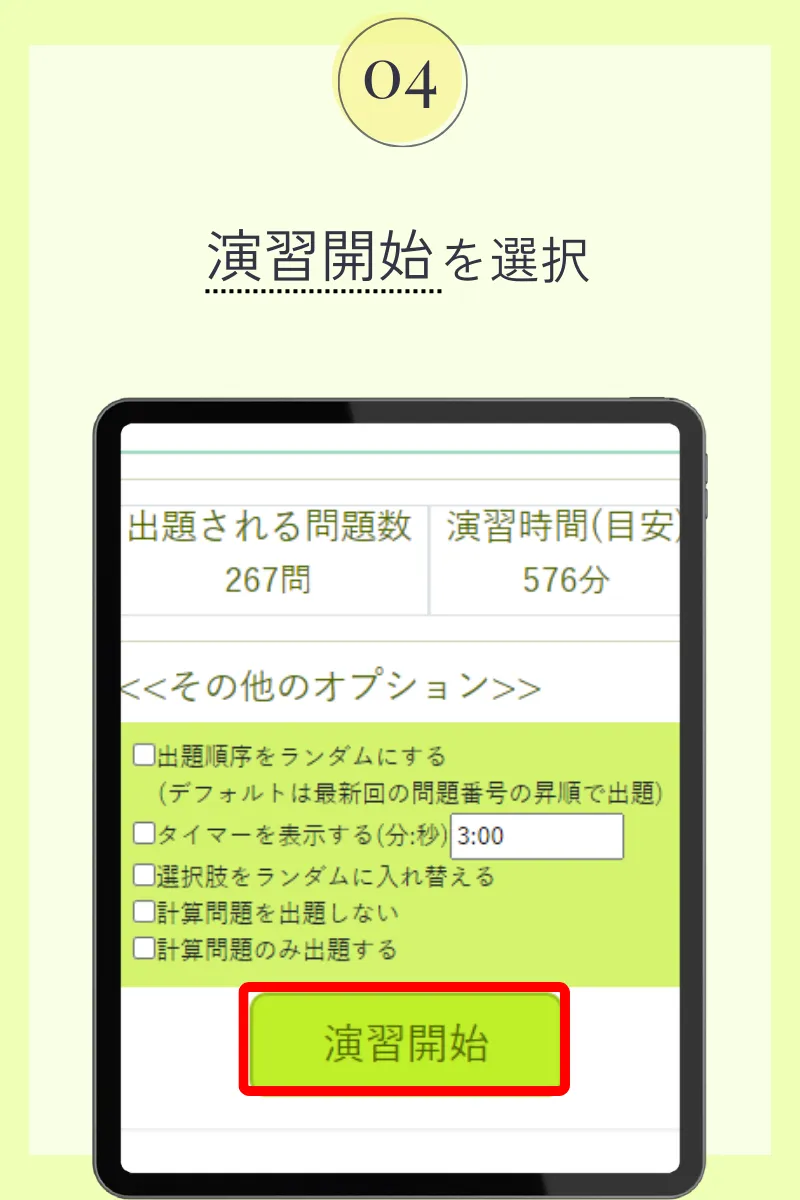
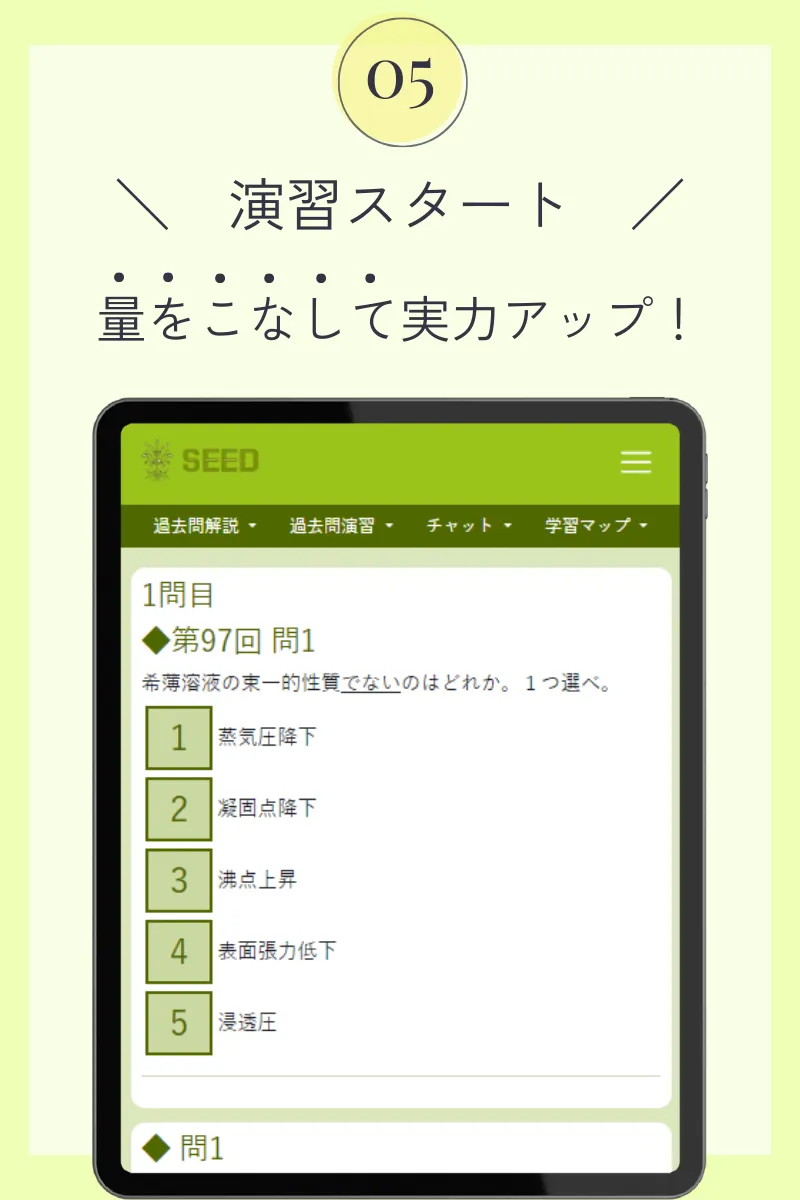
第110回薬剤師国家試験
◆ 問3
難溶性塩である水酸化鉄(Ⅲ)(Fe(OH)3)の純水中での溶解度をSmol/Lとすると、その溶解度積(Ksp)を正しく表しているのはどれか。1つ選べ。-
3S3(mol/L) 3
-
4S3(mol/L)3
-
9S3(mol/L)3
-
9S4(mol/L) 4
-
27S4(mol/L)4
◆ 問3
◆領域・タグ
◆正解・解説
正解:5
※10~40秒程度掛かります。APIリクエストエラーが発生した場合は再実行することで解消される場合があります。
投稿しました!
◆ユーザー投稿の解説
ゲスト さんが投稿
``` 水酸化鉄(Ⅲ) (Fe(OH)3) の溶解平衡と溶解度積に関する問題解説 Fe(OH)3 は難溶性塩であり、水中でわずかに溶解して、鉄(Ⅲ)イオン (Fe3+) と水酸化物イオン (OH-) を生成します。この溶解平衡は次のように表されます。 Fe(OH)3 (s) ⇌ Fe3+ (aq) + 3OH- (aq) 溶解度を *S* mol/L とすると、平衡時の各イオンの濃度は以下のようになります。 [Fe3+] = *S* mol/L [OH-] = 3*S* mol/L 溶解度積 *K*sp は、各イオンの濃度の積で表され、以下の式で計算できます。 *K*sp = [Fe3+][OH-]3 = (*S*) (3*S*)3 = *S* * 27*S*3 = 27*S*4 (mol/L)4 **選択肢の解説** 1. 3*S*3(mol/L)3: 誤り。水酸化物イオンの係数を考慮していません。 2. 4*S*3(mol/L)3: 誤り。水酸化物イオンの係数を考慮していません。 3. 9*S*3(mol/L)3: 誤り。水酸化物イオンの係数を考慮していません。 4. 9*S*4(mol/L)4: 誤り。水酸化物イオンの係数を考慮していません。 5. 27*S*4(mol/L)4: 正解。鉄(Ⅲ)イオンと水酸化物イオンの濃度、および水酸化物イオンの係数を正しく考慮しています。 ```
Good: 1
Bad: 0