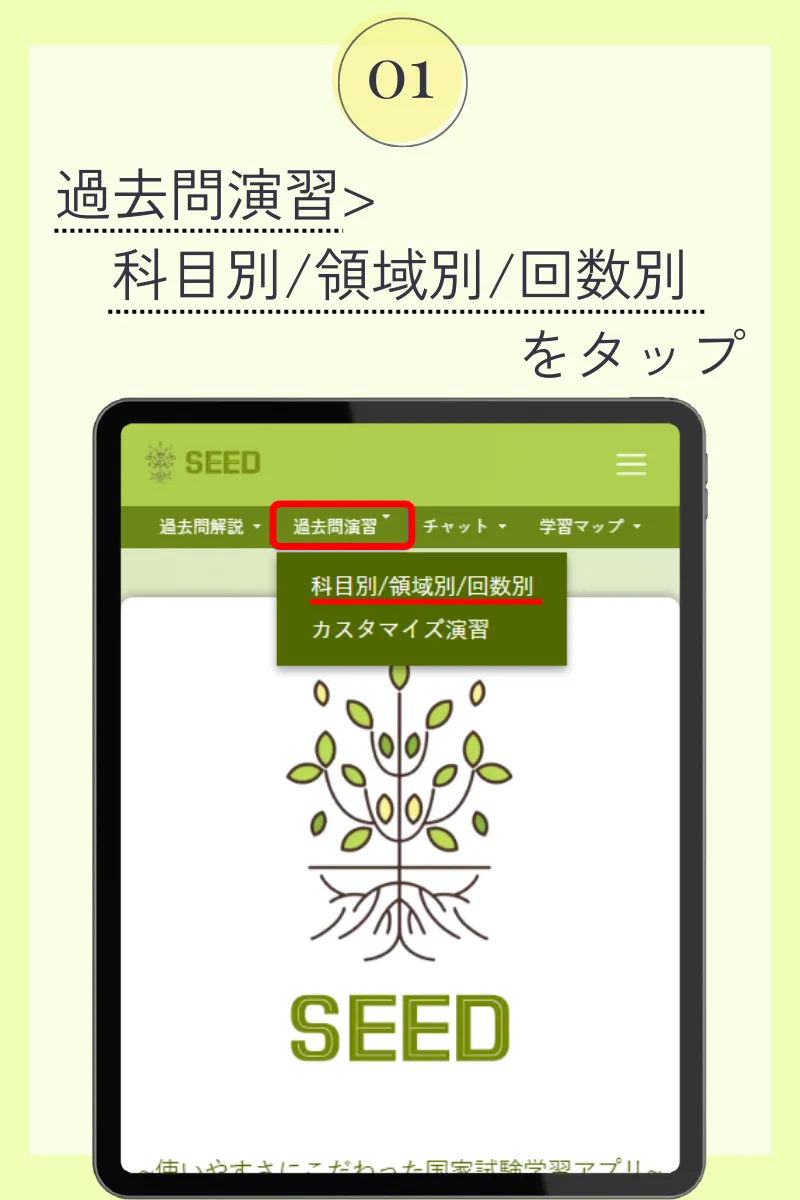
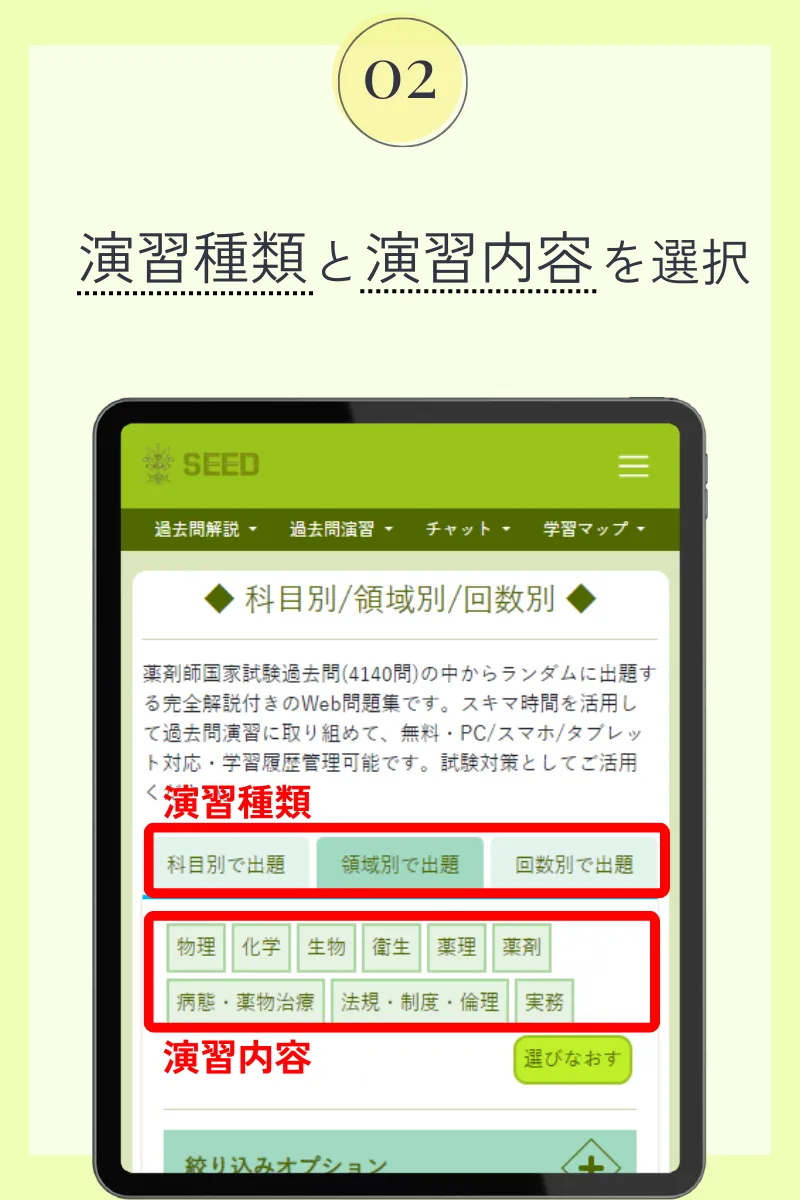
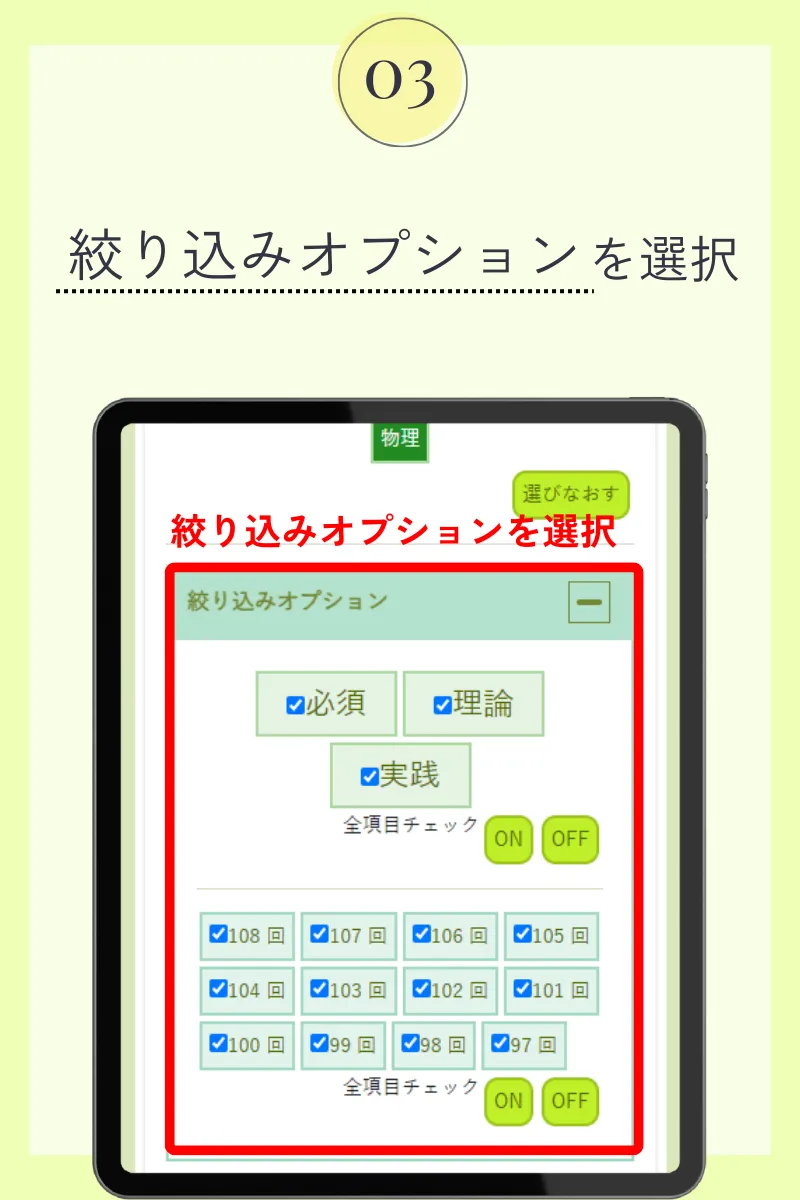
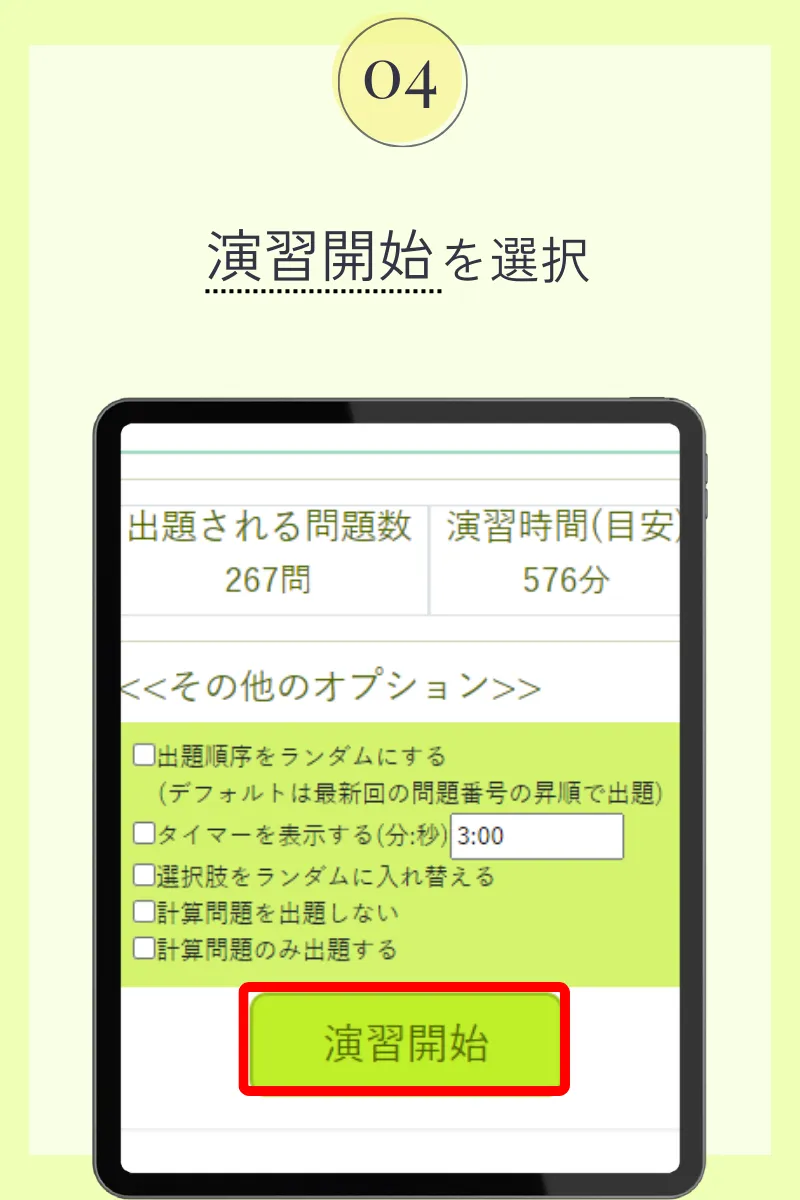
第98回薬剤師国家試験
◆ 問91
熱力学に関する記述のうち、誤っているのはどれか。1つ選べ。-
系の内部エネルギーは、その系の現在の状態だけで決まり、その状態に至る経路は関係しない。
-
孤立系で不可逆変化が起これば、エントロピーは増大する。
-
状態量には示強性と示量性があり、温度は示量性の状態関数である。
-
熱力学第三法則でいう純物質の完全結晶のエントロピーは、絶対零度ではゼロである。
-
ギブズ自由エネルギーは、エントロピー、エンタルピー及び温度の関数である。
◆ 問91
◆領域・タグ
◆正解・解説
正解:3
1 正しい
系の内部エネルギーは状態関数であるため、その系の現在の状態だけで決まり、その状態に至る経路は関係しない。なお、その状態に至る経路により変化するのは、熱、仕事などの経路関数である。
2 正しい
熱力学第二法則では、「可逆過程では孤立系のエントロピーは一定であり、不可逆過程では孤立系のエントロピーは増大する。」と定義されている。したがって、「孤立系で不可逆変化が起これば、エントロピーは増大する。」といえる。
3 誤っている
状態量には示強性(系の大きさや系に含まれる物質量に依存せず、加成性を示さない)と示量性(系の大きさや系に含まれる物質量に依存し、加成性を示す)があり、温度は示強性の状態関数である。
4 正しい
5 正しい
ギブズ自由エネルギーは、エントロピー、エンタルピー及び温度の関数であり、次式で表される。
G=H−T・S
(G:ギブズ自由エネルギー、H:エンタルピー、T:絶対温度、S:エントロピー)