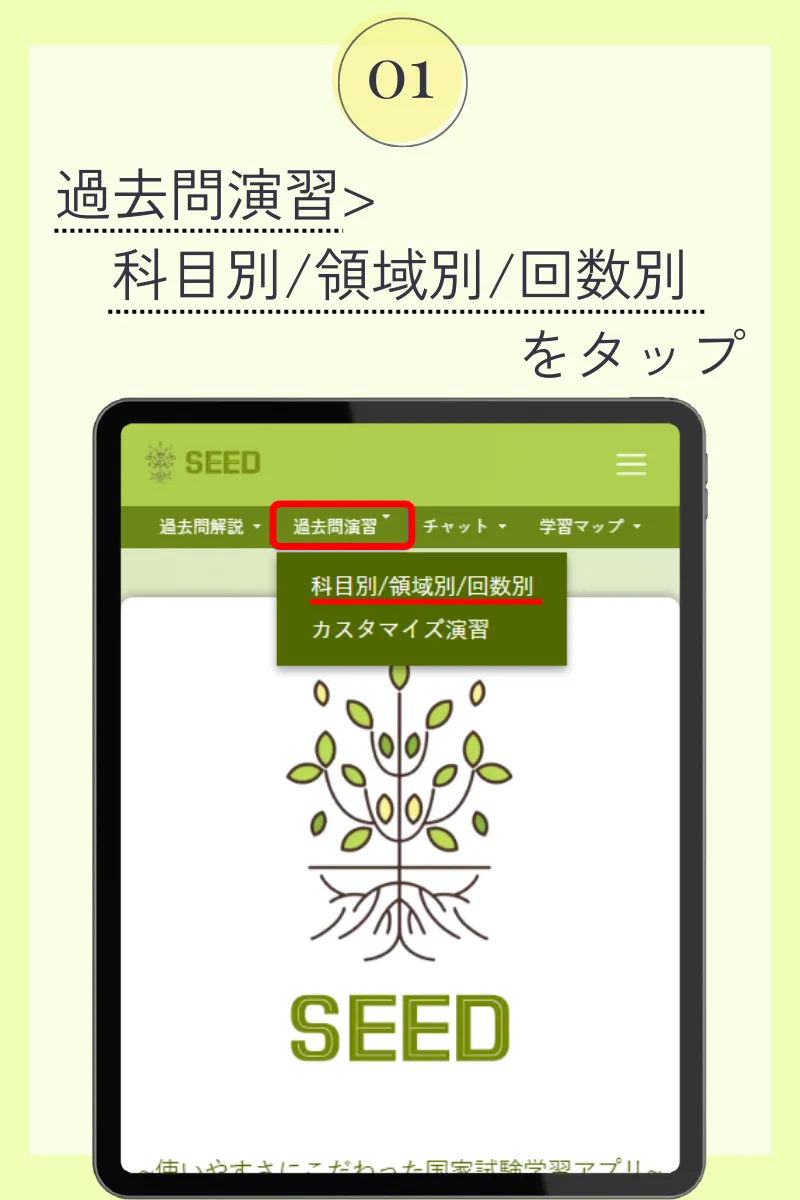
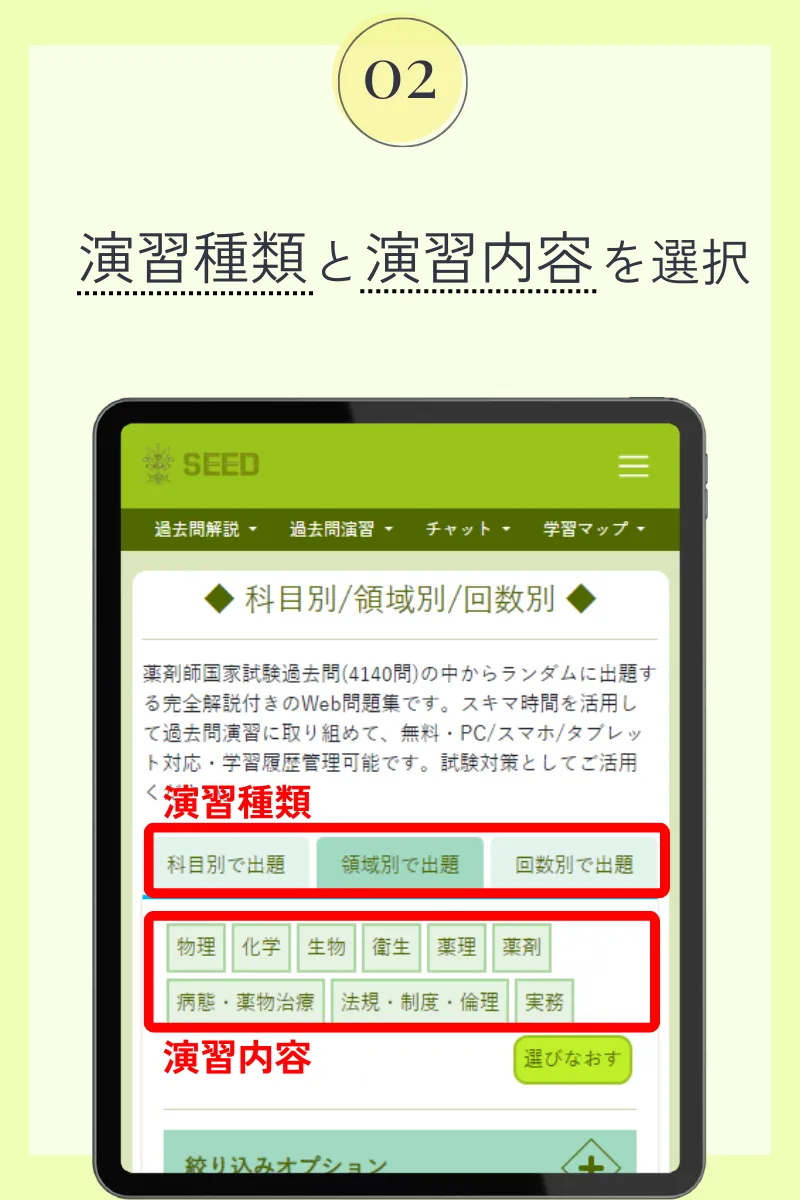
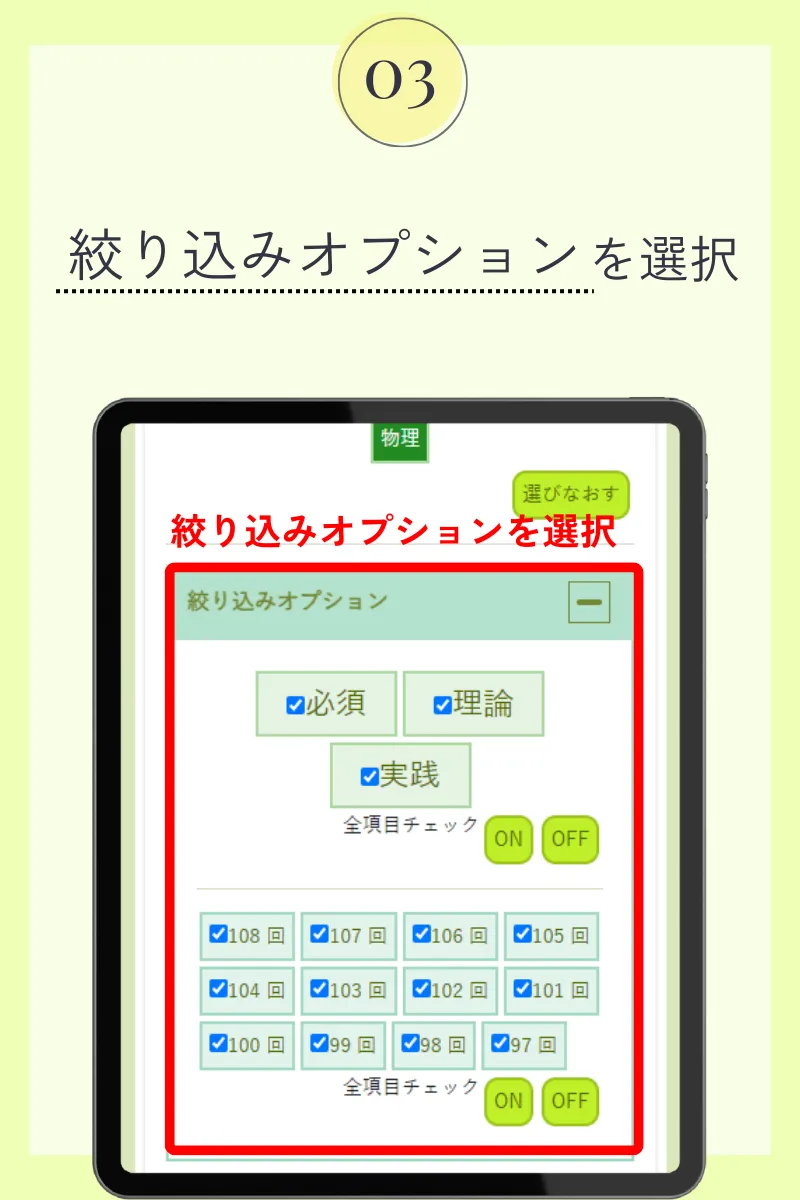
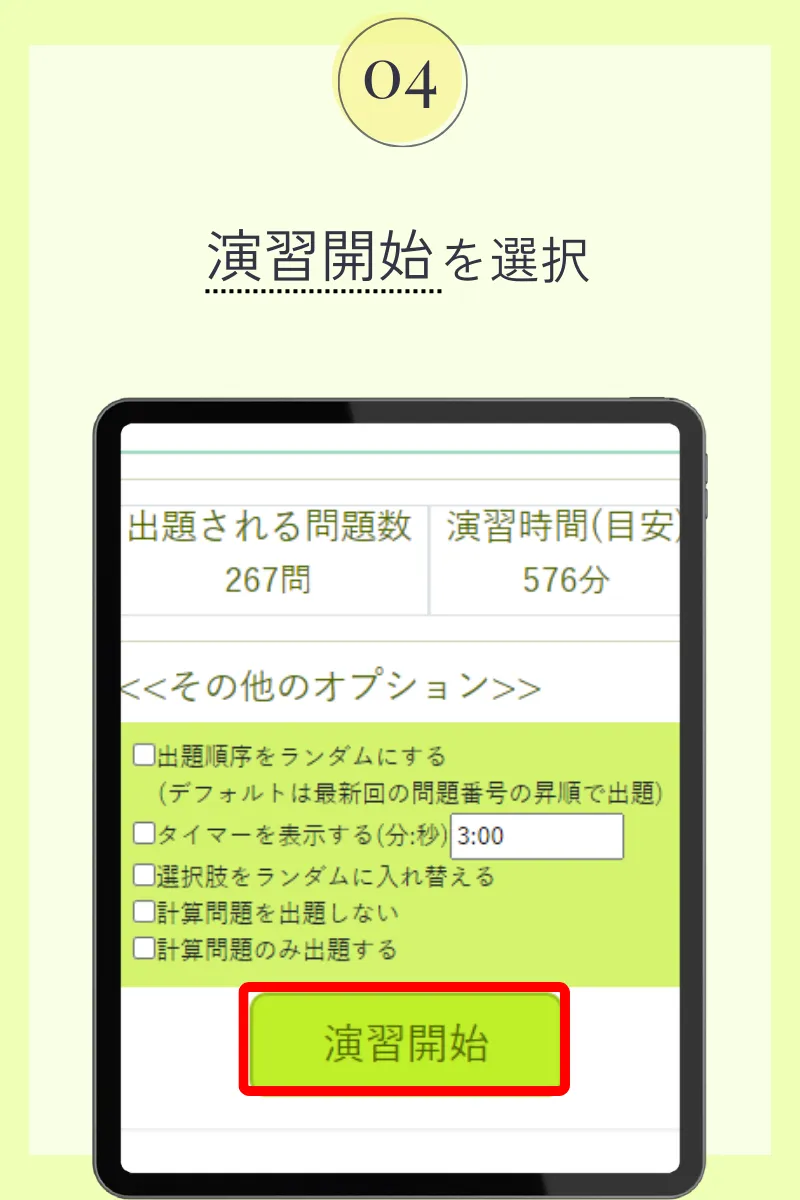
第99回薬剤師国家試験
◆ 問174
pKa=5.2の1価の弱酸性薬物水溶液に関する記述のうち、正しいのはどれか。1つ選べ。ただし、イオン形薬物はすべて溶解するものとする。-
pH5.2の溶液中では、分子形の薬物のみが存在する。
-
pH7.2の溶液中では、イオン形薬物分率は約1%である。
-
pH6.2における溶解度は、pH5.2と比較して約10倍である。
-
pH7.2における溶解度は、pH5.2と比較して約50倍である。
-
pH7.2における溶解度は、pH5.2と比較して約100倍である。
◆ 問174
◆領域・タグ
◆正解・解説
正解:4
弱酸性薬物の分子形の濃度とイオン形の濃度の比は、以下の式(Henderson−Hasselbalch式)で表される。
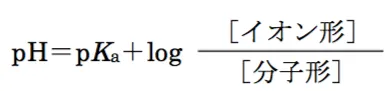
また、弱酸性薬物の溶解度Csは、以下の式より求めることができる。
Cs=Cs分子(1+10pH-pKa)
<分子形の濃度とイオン形の濃度の比を求める>
pH=5.2
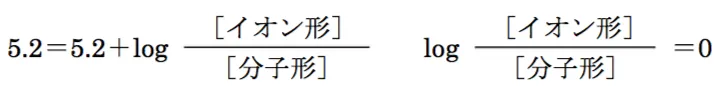
分子形:イオン形=1:1
pH=7.2
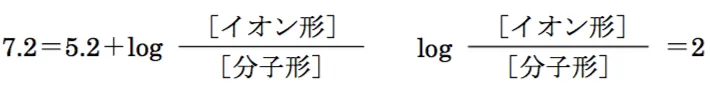
分子形:イオン形=1:100
*pH7.2におけるイオン形分率は100/101×100≒99(約99%)
<溶解度を求める>
pH5.2
Cs=Cs分子(1+105.2-5.2)=2×Cs分子
pH6.2
Cs=Cs分子(1+106.2-5.2)=11×Cs分子
*pH5.2に比べ、約5倍
pH7.2
Cs=Cs分子(1+107.2-5.2)=101×Cs分子
*pH5.2に比べ、約50倍
これらのことから、「pH7.2における溶解度は、pH5.2と比較して約50倍である。」