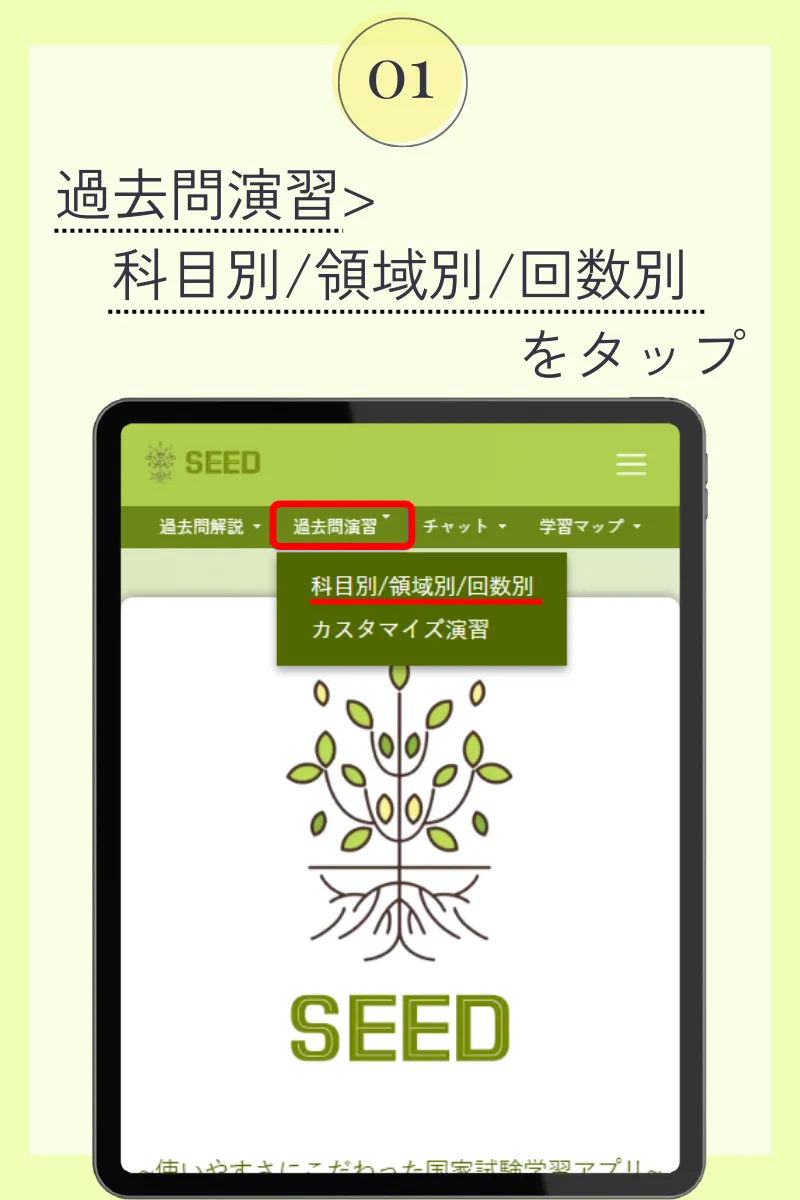
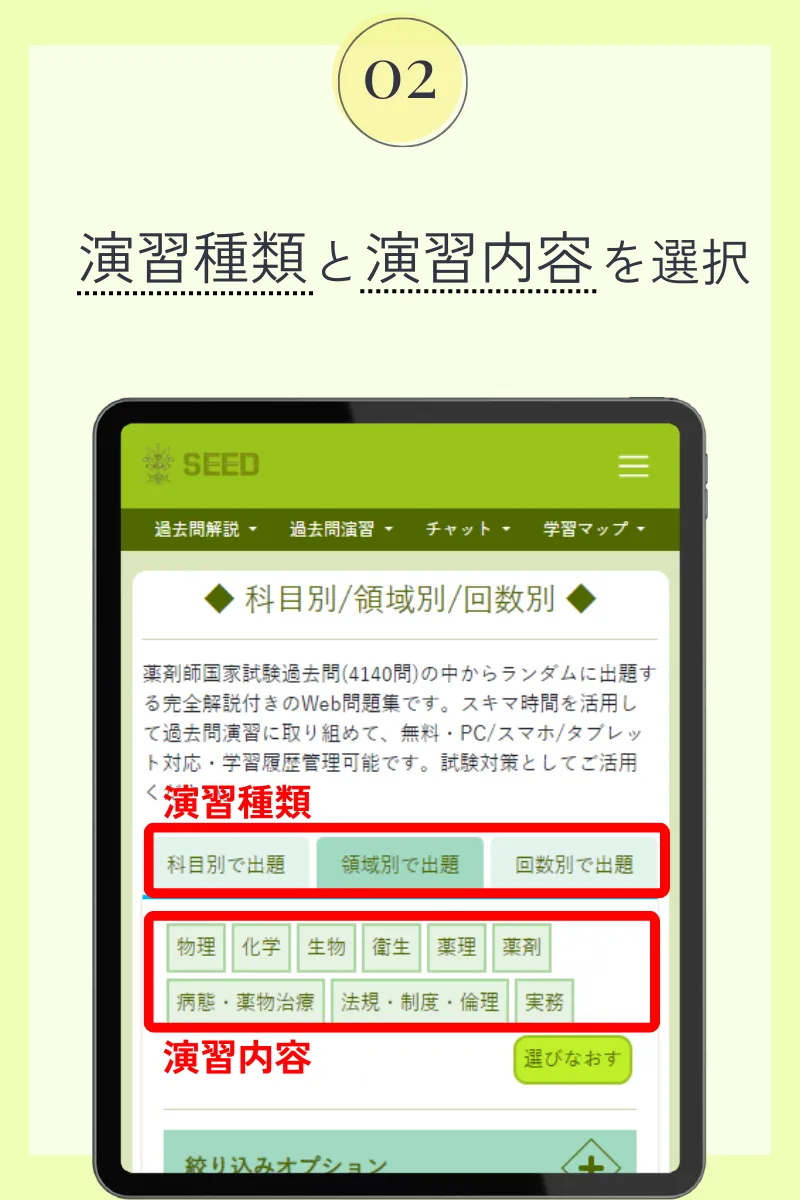
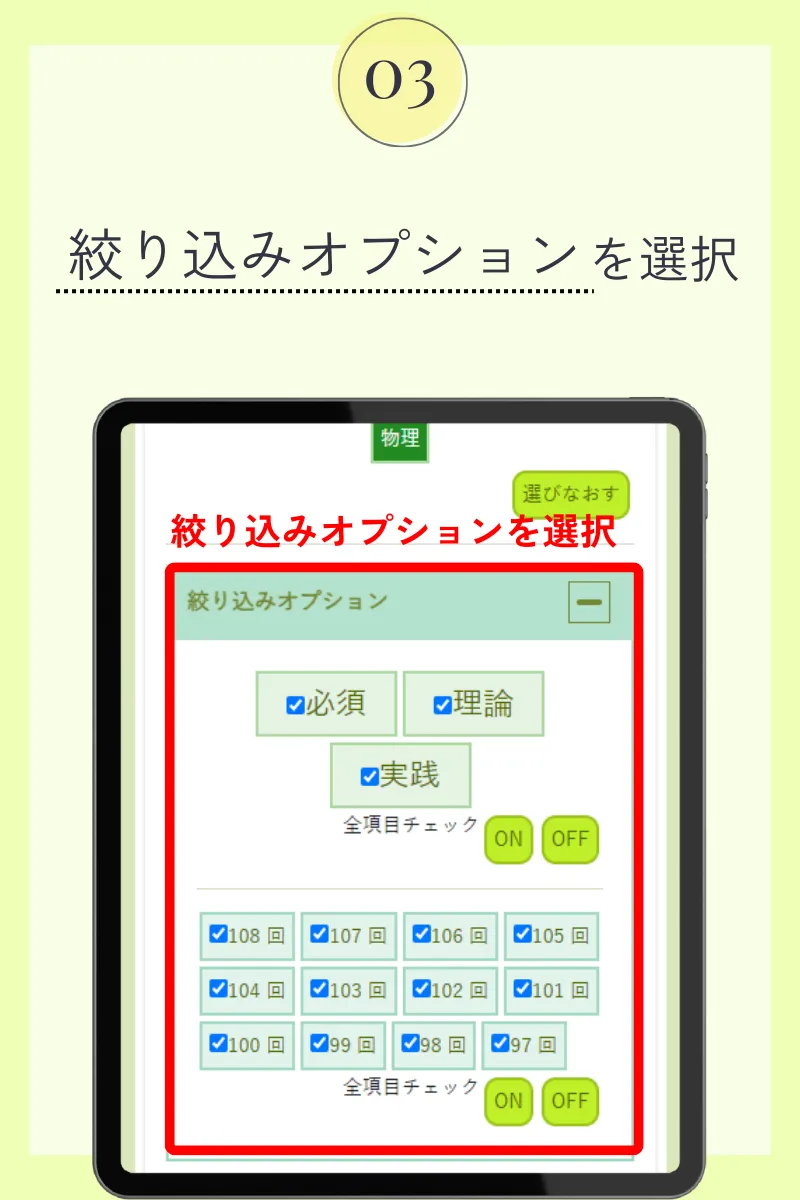
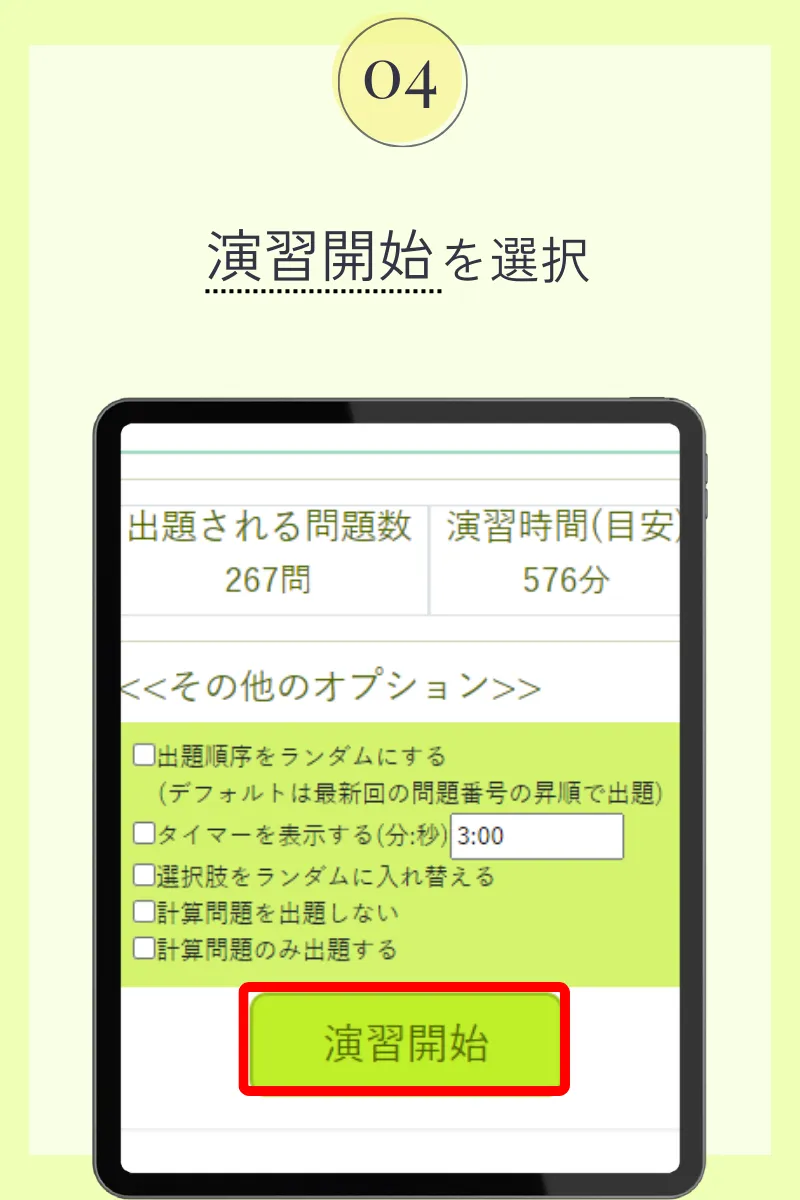
第99回薬剤師国家試験
◆問320-321
50歳男性。狭心症、脂質異常症及び頻尿で処方1の薬剤を服用していた。今回、患者の勃起不全に対し、他の医療機関から処方2の薬剤が処方された。処方2の薬剤を服用した後、患者は急激な血圧低下により意識障害を起こし救急車で病院に運ばれた。
◆ 問320
処方1の中でシルデナフィルクエン酸塩と併用禁忌の薬剤はどれか。1つ選べ。-
プロピベリン塩酸塩錠20 mg
-
シンバスタチン錠5 mg
-
硝酸イソソルビド徐放カプセル20 mg
-
アロチノロール塩酸塩錠10 mg
-
イコサペント酸エチル粒状カプセル600 mg
◆ 問321
◆ 問320
◆領域・タグ
◆正解・解説
正解:3
処方1の中でシルデナフィルクエン酸塩と併用禁忌の薬剤は、硝酸イソソルビド徐放カプセルである。シルデナフィルは、ホスホジエステラーゼVを阻害することによりサイクリックGMP(cGMP)量を増加させ、血管平滑筋を弛緩させる。一方、硝酸イソソルビドは、グアニル酸シクラーゼを活性化し、cGMP量を増加させ、血管平滑筋を弛緩させる。このことより、両剤を併用するとcGMPが増加し、過度の血圧低下を起こす可能性があるため、両剤は併用禁忌とされている。
◆ 問321
◆領域・タグ
◆正解・解説
正解:1、4
製造販売業者は、医薬品の副作用により意識障害等の死亡につながるおそれのある症例を知ったとき、以下のように対応する必要がある。
・使用上の注意から予測できないものである場合→15日以内に厚生労働大臣に報告
・新医薬品で市販後2年を経過していないものである場合→15日以内に厚生労働大臣に報告
・上記以外の場合→30日以内に厚生労働大臣に報告
本症例における副作用は、添付文書に記載されている副作用であり予測することが可能であるため、製造販売業者は、30日以内に厚生労働大臣へ報告する必要がある。
製造販売業者は、医薬品等の適正な使用のために必要な情報(医薬品の品質、有効性、安全性に関する情報等)の収集業務を、他者に委託することができる。
病院の医師が厚生労働大臣に対し、副作用報告した場合でも、製造販売業者は、企業報告制度として副作用報告を行う義務がある。
病院開設者、薬局開設者または医師、歯科医師、薬剤師その他の医療関係者は、製造販売業者の副作用症例の情報収集業務に協力するよう努める必要がある。
病院開設者は、院内で発生した全ての重篤な副作用症例を管轄の保健所長に対し報告する必要はない。なお、病院開設者、薬局開設者または医師、歯科医師、薬剤師その他の医療関係者は、重篤な副作用症例のうち、保健衛生上の危害の発生又は拡大を防止する必要があると認めるときは、その旨を厚生労働大臣に報告する必要がある。